–만 36세의 젊은 과학자가 생체 리듬 유지에 필수적인 유전자 ATAXIN-2 (어택신-투) 연구를 통해 루게릭, 파킨슨병과 같은 퇴행성 뇌질환 발병 원인을 밝히고, 퇴행성 뇌질환 치료에 새로운 지평을 열 연구 결과를 세계 최고 권위의 과학학술지인 ‘사이언스 (Science)’誌에 발표해 화제다.
미국 노스웨스턴 대학교 (Northwestern University) 신경생물학과의 라비 알라다 교수 (Prof. Ravi Allada, 교신저자)와 임정훈 박사 (제1저자, 현 UNIST 나노생명화학공학부 조교수)는 퇴행성 뇌질환 유전자로 알려져 있는 ATAXIN-2 (어택신-투)가 생체 리듬 유지에 필수적인 유전자로서 작용되는 점을 세계 최초로 발견하는 등 퇴행성 뇌질환 발병 원인과 치료에 단서가 될 획기적인 연구 결과를 ‘사이언스 (Science)’誌에 발표(5월16일)했다.
ATAXIN-2 유전자에 이상이 있을 경우, 소뇌, 뇌간 및 척수가 점진적으로 퇴화되는 척수소뇌실조증 (spinocerebellar ataxia type2, SCA2), 루게릭 병(amyotrophic lateral sclerosis, ALS; Lou Gehrig’s disease), 파킨슨 병(Parkinson’s disease) 등과 같은 퇴행성 뇌질환이 발병한다.
하지만, 이처럼 퇴행성 뇌질환 발병의 중요한 요소인 ATAXIN-2 유전자의 분자 생물학적 기능, 특히 퇴행성 뇌질환을 일으키는 신경세포학적 역할에 대해서는 규명된 바 없다.
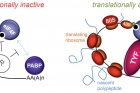
임정훈 박사 연구팀은 이를 규명고자 초파리 모델 시스템과 단백질 질량 분석법을 이용하여 ATAXIN-2와 TYF가 생체 리듬을 주관하는 신경 세포내에서 특이적인 단백질 복합체를 형성하는 것을 밝혀냈다.
그리고 번역(translation) 촉진기능에 필요한 TYF단백질 복합체가 ATAXIN-2 단백질에 의해 형성되며, 이러한 단백질 복합체 내에서 ATAXIN-2가 전령 RNA의 전사 후 번역을 통한 단백질 합성을 직접적으로 촉진 시키는 중요 요소(전사 후 공활성화 인자)로 작용한다는 새로운 사실을 입증했다.
임정훈 박사는 또한 다양한 형질 전환 초파리의 일주기성 행동 변화와 생체 리듬 세포 내의 유전자 발현을 분석함으로써, ATAXIN-2와 TYF의 결합이 생체 리듬을 유지시키는데 중요함을 증명하는데 성공했다.
특히 ATAXIN-2 단백질의 발현을 생체 시계 뉴런 내에서 특이적으로 저해할 경우, PERIOD(피어리어드)라고 불리는 생체시계 유전자의 단백질 합성이 저해되고, 결과적으로 일주기성 생체 리듬이 사라지는 현상을 발견했다.
이 연구 결과는 생체리듬을 조절하는 신경 세포에 특이적으로 작용하는 전사 후 조절 인자들과 이에 결합하는 전령RNA로 구성된 리보핵산 단백질 복합체를 규정하고 그 기능을 다양한 접근 방식으로 밝힘으로써, 생체리듬 조절 메커니즘에 있어 ATAXIN-2 유전자에 의한 전사 후 조절 기작의 중요성을 세계 최초로 입증하였다.
또한 ATAXIN-2가 신경세포 내에서 전령 RNA로부터 단백질 합성을 촉진시키는 새로운 기능을 최초 규명함으로써 ATAXIN-2 관련 퇴행성 뇌질환 발병의 새로운 모델을 확립했다는데 큰 의의가 있다. 다시 말해 ATAXIN-2 유전자에 돌연변이가 발생하여 ATAXIN-2에 의해 조절되는 유전자들의 단백질 합성이 저하되고, 더불어 노화에 의해 이러한 결함이 가중돼 신경세포들이 더욱 퇴화하는 결과로써 퇴행성 뇌질환이 발병하게 되는 것이다.
2013년 3월 1일자로 UNIST에 임용된 임정훈 교수는 “이 논문에서 밝혀낸 ATAXIN-2의 새로운 기능은, 관련 퇴행성 뇌질환 환자들에게서 나타나는 수면 질환을 설명할 뿐만 아니라 앞으로 ATAXIN-2에 의한 여러 가지 퇴행성 뇌질환의 발병 원인 연구와 그 치료에 새로운 패러다임을 제시할 것으로 기대한다”고 연구 의의를 밝혔다.