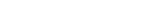치매를 치료하고 정확한 원인도 파악할 ‘화학도구 설계 기술’이 개발됐다. 이 기술로 만든 분자들은 치매 원인별로 적용할 수 있으며, 동물 실험에서도 효과를 보였다. 치매의 진단과 치료제 개발은 물론 연구에도 기여할 전망이다.
자연과학부의 임미희 교수팀과 김광수 교수는 서울아산병원의 이주영 교수팀과 공동으로 알츠하이머성 치매의 원인을 골라서 제거할 수 있는 저분자 화합물을 설계하는 ‘화학도구 설계 기술’을 개발했다. 알츠하이머병의 원인으로 알려진 각 요소에 대응하기 알맞은 ‘분자 구조’와 ‘반응 메커니즘’까지 고려해 저분자 화합물을 만드는 전략이다.
최근 10년 사이 알츠하이머 환자는 1000만 명 이상 늘어났다. 하지만 이렇다 할 치료법이 없고, 발병 원인도 명확히 파악되지 않았다. 가설로 제시된 원인은 ‘금속 이온’, ‘아밀로이드-베타 단백질’, ‘금속과 결합된 아밀로이드-베타 단백질’, ‘활성산소종’ 등이다. 최근 연구에서 여러 원인이 복합적으로 작용해 알츠하이머병을 일으킨다고 정리된 정도다.
임미희 교수는 “지금까지 알려진 원인들이 알츠하이머병 유발에서 어떤 역할을 하는지 파악해야 치료제 개발도 효과적일 것”이라며 “이번 기술은 분자 구조와 작용 메커니즘까지 함께 고려해 치료제 개발과 원인 파악에 유용할 것”이라고 설명했다.
임 교수팀은 환자마다 알츠하이머병 유발 요소의 분포가 다르다는 점에 주목했다. 환자들의 혈액이나 뇌 조직에서 각 요소가 동일하게 나타나지 않았던 것이다. 이에 각 요소를 억제하는 최적의 분자를 설계하면 효과적인 치료가 가능하다고 판단했다. 또 이 분자들이 각 원인을 억제하는 과정을 관찰하면 알츠하이머병이 발생하는 구체적인 메커니즘도 명확하게 밝힐 수 있다.
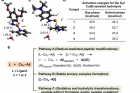
연구진은 알츠하이머병의 각 요소를 억제하는 최적의 분자를 찾았다. 금속 이온과 잘 결합하는지, 아밀로이드-베타 단백질과 어떤 작용을 하는지, 저분자 화합물의 이온화 에너지는 어느 정도인지 등이 고려됐다.
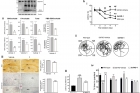
그 결과 총 4개의 분자가 설계됐고, 각 분자가 어떤 메커니즘으로 알츠하이머병 발병 요소의 독성을 억제하는지 규명됐다. 어떤 분자는 아밀로이드-베타 단백질을 산화하거나 분해하는 방식으로 독성을 억제했다. 다른 분자는 아밀로이드-베타 단백질과 금속 이온, 분자로 이뤄진 복합체를 이뤄 독성을 누그러트렸다.
이 분자들은 동물 실험에서도 효과를 보였다. 사람의 치매 유전자를 가진 ‘알츠하이머 마우스 모델(5XFAD)’에 분자들을 주사하자, 뇌 안에 축적된 아밀로이드-베타 종들이 확연히 줄었다. 실험쥐들의 인지능력과 기억력이 개선되는 효과도 확인됐다.
임미희 교수는 “이번 연구로 단순한 화학구조를 변화시켜 알츠하이머병 유발 인자를 골라서 잡을 수 있다는 걸 밝혔다”며 “알츠하이머병의 발병 요소 간의 연관성은 물론 각각의 역할을 규명하는 후속 연구에도 도움이 될 것”이라고 말했다.
임 교수는 이어 “기존 화학도구 설계에서는 화합물 구조만 이용했지만, 이번에는 메커니즘까지 고려해 정확도를 높였다”며 “저분자 화합물을 이용해 합리적인 화학도구를 만드는 새로운 원리를 제시했다는 점에서도 큰 의미가 있다”고 강조했다.
이번 논문은 세계적으로 저명한 학술지인 ‘네이처 커뮤니케이션(Nature Communications)’ 10월 13일자(현지시각)에 게재됐다. 이번 연구는 UNIST 미래전략과제와 한국연구재단 등에서 지원받아 진행됐다.