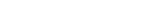질병 원인으로 꼽히는 ‘막단백질’의 구조를 파악할 새로운 기술이 개발됐다. 신약 개발에서 고난이도로 꼽히던 단계를 해결해 각종 치료제 개발을 앞당길 전망이다.
이현우 자연과학부 교수팀과 서울대 기초과학연구원(IBS) RNA연구단 김종서 교수팀은 세포 속 미토콘드리아의 막단백질에 특정한 화학물질을 붙여 구조를 이해할 수 있는 새로운 기술을 개발했다. 이 기술을 활용한 결과, 미토콘드리아 내막단백질 135개의 구조를 확인하거나 바로잡았다. 미토콘트리아 내막단백질의 구조를 정확히 보여주는 지도 완성에 한걸음 다가선 셈이다.
이현우 교수는 “막단백질은 단백질 구조 분석 중에서도 고난이도 과제로 꼽힌다”며 “이번 기술은 미토콘드리아 막단백질뿐 아니라 다른 세포 소기관의 막단백질에도 적용해 구조 정보를 파악하는 데도 활용할 수 있다”고 밝혔다.
막단백질은 세포막에 끼어있는 단백질로 세포 내에 영양분이나 신호를 전달하는 중요한 역할을 한다. 이 기능이 망가지면 질병이 생길 수 있어 신약 개발에서는 막단백질을 이해하는 게 중요한 과제다.
이현우 교수팀은 살아있는 세포 속 미토콘드리아의 내막에 있는 단백질을 ‘디싸이오바이오틴–페놀(Desthiobiotin-phenol)’을 붙인 다음 질량 분석기로 분석하는 방법으로 막단백질의 구조를 파악했다.
고리 모양의 구조를 가지는 화합물인 페놀(phenol)이 페놀라디칼(phenol radical)이 되면 아미노산의 일종인 ‘타이로신(tyrosin)기’에 잘 달라붙는다. 대부분의 단백질이 타이로신기를 하나 이상 가지고 있기 때문에 막단백질 구조 분석에 이용할 수 있다. 막단백질은 주로 막(membrane)에 끼어 있는데, 그 방향성이 중요하다. 세포막의 안쪽과 바깥쪽 모두에 페놀 종류로 염색하면, 타이로신기가 있는 부분에 꼬리표를 붙일 수 있다. 그 결과 막단백질이 어느 쪽으로 튀어나와 있는지 알 수 있다.
타이로신기를 페놀 종류로 염색하는 데는 과산화효소인 ‘에이펙스(APEX)’가 사용됐다. 이 효소는 세포의 어느 공간에서나 활성화되는데, 과산화수소를 만나면 페놀 종류의 수소 원자 하나를 빼앗아 반응성이 큰 페놀라디칼을 생성한다. 이 페놀라디칼은 타이로신과 공유결합을 이루므로 특정 단백질에 꼬리표를 붙일 수 있다.
이번 연구에서 쓰인 페놀 종류인 디싸이오바이오틴–페놀은 기존 연구에서 사용했던 바이오틴–페놀(Biotin-phenol)보다 염색된 단백질 조각(펩타이드)을 많이 회수할 수 있는 물질이다. 질량분석기로 분석할 시료가 많아지면 막단백질 구조 파악의 효율도 높아진다.
이번 연구에 제1저자로 참여한 이송이 UNIST 자연과학부 석박사통합과정 연구원은 “미토콘드리아의 기질과 막사이공간에 모두 과산화수소를 넣어 반응을 유도하면, 타이로신기가 튀어나온 방향에만 디싸이오바이오틴-페놀이 붙게 된다”며 “과산화효소 반응을 마친 세포를 깨트려 단백질을 자르고 질량분석기로 분석하면 막단백질의 방향성을 파악할 수 있다”고 말했다.
이현우 교수는 “미토콘드리아 막단백질 복합체의 구조를 이해하는 일은 미토콘드리아를 겨냥한 새로운 치료법을 개발하는 데 있어서 아주 중요하다”며 “새로운 페놀 화합물을 이용해 막단백질의 구조를 파악하는 기술은 다른 막단백질을 표적으로 하는 신약 개발에도 도움을 줄 것”이라고 전망했다.
이번 연구는 화학 분야의 세계적인 권위지인 미국화학회지(JACS)에 게재됐다. 연구지원은 보건복지부/한국보건산업진흥원의 질환극복기술개발사업(세계선도 의생명과학자 육성)와 기초과학연구원(IBS)을 통해 이뤄졌다.