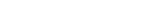뇌신경세포 발달에 문제가 생기면 지적장애를 비롯한 각종 뇌질환이 나타난다. 이를 예방하거나 치료하려면 뇌신경세포가 어떻게 만들어지는지 알아야 하는데, 최근 국내 연구진이 이를 조절하는 핵심 단백질의 생성원리를 밝혔다.
민경태 UNIST 생명과학부 교수팀과 김경태 POSTECH 융합생명과학부 교수팀은 신경세포의 발달과 시냅스(synapse) 형성에 중요한 단백질, ‘코필린(cofilin)’의 발현 메커니즘을 처음으로 명확하게 규명했다.
인간의 뇌 속에는 대뇌피질에만 약 100억 개의 신경세포(neuron)가 존재한다. 신경세포끼리 연결된 구조를 시냅스라고 하는데, 여기서 신호가 전달돼 정보처리와 저장이 이뤄진다. 시냅스 구조는 자극에 따라 역동적으로 조절돼 숫자나 모양이 달라진다. 이때 신경세포 끝에서 가지처럼 뻗어나가는 축삭돌기(axon)의 방향 설정이나 성장속도가 매우 중요하다.
김경태 POSTECH 교수는 “시냅스 연결이 정확하지 않으면 뇌세포 간에 신호전달이 방해될 뿐 아니라 기억과 학습 능력에도 차질이 생긴다”며 “이번 연구로 뇌 발달에 대한 근본적인 이해가 가능해져 뇌 발달장애의 예방과 치료에 크게 기여할 것”이라고 밝혔다.
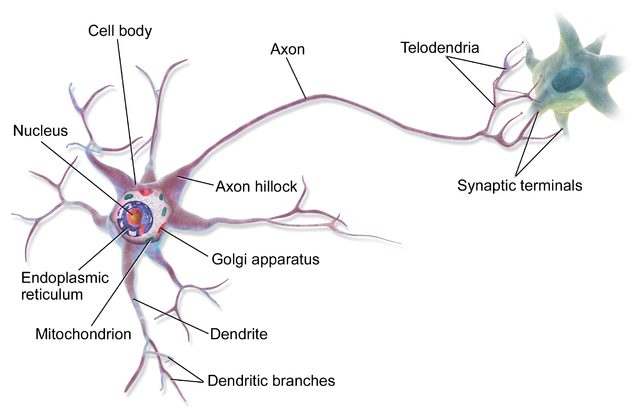
코필린은 액틴(actin)이라 불리는 미세섬유와 상호작용해 신경세포 축삭돌기의 성장 속도와 방향조절을 유도한다. 그런데 코필린 자체가 어떻게 만들어지는지 밝혀지지 않았다. 연구진은 코필린 단백질의 번역이 일반적인 번역과 다르다는 점에 주목해 이번 연구를 진행했다.
일반적으로 생체 내에서 단백질은 DNA에 있는 유전정보를 가져와, 단백질 아미노산에 맞는 암호로 바꾼 뒤(전사), 리보솜(ribosome)에서 합성(번역)된다. 복제된 유전정보는 mRNA(messenger RNA)가 전달하는데, 이때 다양한 유전인자가 달라붙어 리보솜을 끌어오면서 단백질 합성이 시작된다.
그런데 기존 번역방식과 다르게, 코필린 mRNA 앞에는 아이리스(IRES, Internal Ribosme Entry Site) 활성을 가지는 부위가 있었다. IRES가 활성화되면 mRNA를 리보솜에 바로 연결해 단백질 합성을 시작할 수 있다. 숙주를 감염시켜야 하는 바이러스나 위급상황에서 빠르게 단백질을 만들 경우 IRES를 활용한다고 알려져 있다.
연구진은 실험을 통해 코필린 단백질의 번역은 IRES를 이용한다는 점을 입증했다. 축삭돌기 말단에서 코필린 mRNA의 IRES에 엔피티비(nPTB)라는 단백질이 결합하면서 코필린 번역이 증가했던 것이다.
제1저자인 최정현 POSTECH 생명과학과 대학원생은 “코필린에서 IRES의 활성을 막자 단백질 합성이 줄어들었고, nPTB를 제거하자 축삭돌기의 회전에 문제가 생겼다”며 “이는 모두 코필린 단백질의 번역이 IRES를 매개로 이뤄진다는 걸 증명한다”고 설명했다.
민경태 UNIST 교수는 “이번 연구를 종합하면, IRES를 매개로 코필린 단백질이 신속하게 합성되면서 액틴의 길이와 방향을 조절해 정확한 시냅스가 형성되도록 돕는다고 정리할 수 있다”며 “뇌신경 발달장애를 막는 핵심 단백질의 생성원리를 밝힌 것이라 향후 지적장애 유발 뇌질환 치료에 큰 역할을 할 것”이라고 기대했다.
이번 연구결과는 분자생물학 분야의 세계적 권위의 학술지인 ‘엠보 저널(The EMBO Journal)’ 2월 12일자 온라인판에 게재됐다. 연구지원은 한국연구재단의 리더연구자지원사업과 뇌과학원천기술과제, 차세대바이오그린21과제를 통해 이뤄졌다.