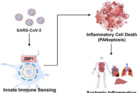
코로나19에 감염된 환자를 사망에 이르게 하는 결정적 유전자가 발견됐다. 세포 속에서 바이러스 감염을 인지하는 선천 면역 센서 중 하나인 ‘ZBP1’이다.
이상준 생명과학과 교수는 ‘선천 면역 센서로 알려진 ZBP1 유전자가 코로나19 환자의 사망률을 높인다’는 연구를 발표했다. 이 유전자는 세포 속에 침투한 바이러스를 인지하고, 면역 단백질인 사이토카인(Cytokine)을 만들라는 신호를 준다. 그런데 코로나19 바이러스(SARS-CoV-2)가 침투한 경우에는 사이토카인을 너무 많이 만들도록 한다. 이 바람에 온몸에 과도한 면역반응으로 인한 염증이 생기고, 사망까지 이르게 되는 것이다.
이상준 교수는 “면역세포는 병원체와 싸우는 중요한 역할을 하지만 잘못하면 스스로 공격하는 ‘양날의 검’이라 면역세포 활성화의 균형이 중요하다”며 “이번 연구는 어떤 선천 면역 센서가 균형을 깨고 사이토카인 폭풍과 사망을 일으키는지 밝혔다”고 말했다.
이상준 교수팀은 코로나19 바이러스에 감염된 대식세포(Macrophage)의 유전자를 제거하는 유전자 가위 기술(genome-wide CRISPR-Cas9 screening)을 이용해 ZBP1 유전자를 찾았다. 이 유전자가 존재하는 대식세포는 코로나19 바이러스 감염에 따른 사이토카인 폭풍으로 사멸하지만, 이 유전자를 제거한 대식세포는 코로나19 바이러스에 감염되어도 사멸하지 않았다.
이 연구에 따르면, ZBP1 유전자는 세포 속에 침투한 코로나19 바이러스를 특별히 잘 인지한다. 위험신호를 잘 감지한 것은 좋지만, 필요 이상으로 사이토카인을 만들어내는 게 문제다. 사이토카인이 너무 많아지면서 동시다발적인 염증성 세포사멸(PANoptosis)이 발생하기 때문이다. 이런 세포사멸은 전신 염증(Systemic imflammation), 즉 사이토카인 폭풍(Cytokine Storm)을 일으켜 환자 사망률을 높인다.
연구진은 바이러스 치료에 흔하게 사용하는 ‘인터페론(Interferon, IFN) 요법’이 코로나19 환자에게는 잘 통하지 않는 이유도 찾아냈다. 인터페론이 ZBP1 유전자를 강력하게 발현시켜 염증성 세포 사멸과 사이토카인 폭풍을 유도한다는 것이다.이 교수는 “인터페론은 면역 센서가 바이러스 등을 인지한 다음에 분비되는 면역물질인데, 그 자체가 바이러스와 싸우는 게 아니라 싸울 수 있는 단백질을 만들어내는 전령 역할을 한다”며 “ZBP1 유전자도 인터페론에 의해 더 강력하게 발현되면서 사이토카인 폭풍을 일으키는 것으로 추정된다”고 설명했다.
코로나19 바이러스에 감염된 소동물 실험에서도 인터페론과 ZBP1 유전자의 관련성이 입증됐다. ZBP1 유전자가 있는 상태에서 인터페론을 주입한 경우만 소동물이 모두 사망한 것. 두 조건 중 하나만 주어지면 소동물이 모두 사망하지는 않았다.
이 교수는 “ZBP1 유전자의 발현을 조절할 수 있다면 면역세포의 활성화 균형을 맞춰 코로나19 환자를 치료하는 새로운 약물을 만들 수 있다”며 “이 방식은 우리 몸이 가진 면역체계를 조절해 면역 염증반응을 막는 것이므로 어떤 바이러스에 감염돼도 치료 가능한 범용성을 가질 수 있을 것”이라고 기대했다.
이번 연구는 미국 세인트 쥬드 아동 연구병원(St.Jude Children’s Research Hospital)과 공동으로 진행됐으며 연구 결과는 ‘사이언스 이뮤놀로지(Science Immunology)’에 게재됐다.
연구 관련 Q&A
Q1. 이번에 발견하신 ‘선천 면역 센서, ZBP1’은 무엇인가요?
A1. 코로나19 바이러스 등에 감염되면, 바이러스가 세포 속으로 들어가서 계속 감염을 유도합니다. 세포 안에서 바이러스를 복제하고, 변이도 일어나는 프로세스가 진행되는 것이죠. 그런 다음에 세포 밖으로 나가서 이웃 세포를 감염시키면서 온몸으로 퍼지는 것입니다.
우리 몸은 여기에 방어할 수 있는 면역체계를 가지고 있습니다. 모든 장기마다 기본적으로 존재하는 대식세포(Macrophage)가 가장 기본적입니다. 대식세포에는 바이러스를 인지할 수 있는 일종의 ‘안테나’ 역할을 하는 리셉터(Recepter)들이 있어요. 이 덕분에 대식세포가 바이러스에 다가가 잡아먹기도 하고, 싸우기도 합니다. 리셉터는 바이러스 바깥뿐 아니라 안에도 있어서 바이러스를 인지하는 역할을 합니다. 이렇게 대식세포 안팎에서 바이러스를 최초로 인지할 수 있는 리셉터들은 ‘선천 면역 센서’라고 부릅니다.
코로나19 바이러스의 경우 세포 밖에서 바이러스를 인지하는 리셉터로 TLR2가 잘 알려져 있습니다. 이번에 발견한 ZBP1은 세포 안에 있는 선천 면역 센서인데, 코로나19 바이러스를 특히 잘 인지한다는 것이 이번에 처음 발견됐습니다.
참고로 면역센서는 각 바이러스마다 조금씩 다르게 반응합니다. ZBP1은 인플루엔자 바이러스를 만나면 적당하게 사이토카인을 분비하여 환자의 생존률을 높이지만, 코로나19 바이러스에 감염됐을 때는 너무 많은 사이토카인을 분비하게 만들어 인체에 해를 줍니다. 이번 논문의 가치는 ZBP1이라는 선천면역센서가 어떻게 면역활성의 균형을 망가트리는지 밝혀냈다는 데 의미가 있습니다.
Q2. ZBP1을 이용한 새로운 치료제 개발은 어떤 방식으로 진행되나요?
A2. 면역세포는 ‘양날의 검’을 가지고 있습니다. 기본적으로는 바이러스 같은 병원균에 대응하지만, 잘못하면 스스로 공격하게 되기도 하기 때문입니다. 따라서 병원균에 대처하는 수준만큼 활성화되도록 선천면역이 균형을 이뤄야 합니다. 참고로 고령이 될수록 선천면역의 균형을 지키기가 어려운데, 코로나19 사망자 중 고령자가 많은 이유도 여기서 엿볼 수 있습니다.
ZBP1 유전자의 발현을 조절할 수 있다면 전신성 과염증에 의한 사망을 막을 수 있다고 봅니다. ZBP1은 이미 단백질 구조가 밝혀져 있습니다. 여기에 반응해 활성을 조절할 수 있는 후보물질을 컴퓨터 모의실험과 실제 FDA 승인 받은 약물을 이용하여 실험하는 방식을 함께 써서 찾아보려 합니다. 두 가지 모두에서 효과적인 약물 후보를 찾는다면 치료제 개발로 이어갈 수 있을 것입니다.
Q3. 바이러스 연구자로서 보시기에, 코로나19 바이러스 확산세는 어떻게 될지 관련 치료제 개발은 어떤 방향이 좋을지 여쭙습니다.
A3. 코로나19 바이러스의 변이는 오미크론까지 이어졌지만, 많은 사람이 백신을 맞아 집단면역이 잘 형성된 그나마 다행스러운 상황입니다. 그래도 코로나19 바이러스가 쉽게 끝나는 건 아닙니다. 1918년 나타난 스페인 독감은 100년이 지난 지금까지도 연구 중인데요. 그 독감을 시발점이 돼 매년 새로운 독감이 돌아오기 때문입니다. 코로나19 바이러스도 이와 비슷한 형태로 가는 게 아닐까 짐작해봅니다. 꾸준히 변이종이 생기고 독감처럼 유행이 돌아오는 형태로요.
따라서 우리는 백신과 치료제 개발을 꾸준히 진행해야 합니다. 현재는 오미크론 변이종이 우세한데, 기존 백신은 초창기 코로나19 바이러스인 알파와 베타, 델타까지 잡을 수 있는 상황입니다. 최근 화이자와 모더나가 오미크론을 잡을 수 있는 백신을 만들긴 했지만, 계속 변이가 나타날 것이므로 새로운 백신과 치료제가 필요합니다. 바이러스 연구자로서는 할 일이 무척 많은 셈이죠.
현재 코로나19 백신은 RNA를 활용하는 덜 안정적인 것을 사용하는데요. 기존 인플루엔자 백신처럼 안정적인 단백질 기반의 백신 개발도 이뤄져야 한다고 봅니다. 백신을 해외에서 수입할 밖에 없는 현실에서 빨리 벗어나도록 우리나라가 주도적으로 백신을 개발할 역량을 갖춰야 합니다. 혹시 새로운 변이가 나타나 위기상황이 온다면 외국에서는 자국민부터 챙길 테니까요.
Q4. UNIST의 바이러스 연구 현황과 장점은 어떤 것이 있을까요?
A4. UNIST는 정말 좋은 연구환경을 가지고 있습니다. 없는 기자재가 없을 정도로 여러 가지가 잘 마련돼 있고, 훌륭한 선배 교수들이 계셔서 협업하면서 배울 점이 많습니다. 연구하고 싶다면 마음껏 뜻을 펼칠 수 있어요. 현재 강세병, 박성호 교수와 함께 ‘신종 바이러스 감염 시 신속한 백신 보급 전략’ 등을 연구하고 있고, ZBP1 유전자 발현을 조절하는 범용 치료제 전략도 고안 중입니다.
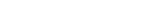


![[연구그림] 코로나19 바이러스의 전신 염증 유발 메커니즘](https://news.unist.ac.kr/kor/wp-content/uploads/2022/09/연구그림-코로나19-바이러스의-전신-염증-유발-메커니즘.png)