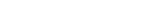우리가 나이를 먹으면 뇌에 철(Fe)이 쌓인다. 철이 많아지면 뇌세포를 죽여 퇴행성 신경질환이 생길 수 있는데, 모두가 그렇지는 않다. 우리 몸은 ‘뇌에 쌓이는 철에 대응할 계획’이 있기 때문이다.
바이오메디컬공학과의 권태준, 조형준 교수팀은 공동연구를 통해 ‘나이를 먹을수록 뇌에 쌓이는 철에 대한 신경세포의 대응 방법’을 규명했다. 노화 동물 모델과 세포주 검증 실험을 통해 단백질 접힘 이상 관련 유전자인 ‘씨엘유(CLU)’와 ‘에이치이알피유디1(HERPUD1)’이 철 독성 해소에 중요한 역할을 한다는 것을 알아낸 것이다.
철과 같은 중금속은 우리 몸에 꼭 필요하지만, 독성을 가지는 활성산소를 발생시키고 DNA 손상이나 세포 사멸을 일으킬 수 있다. 나이가 들면 우리 뇌의 특정 부분에도 철이 쌓인다고 알려져 있다. 특히 대표적 퇴행성 신경질환인 ‘파킨슨병’은 노화 과정에서 ‘뇌의 흑질(substantia nigra, SN)’에 철이 쌓여 생기는 세포 사멸이 영향을 준다고 짐작된다.
그런데 나이가 들면서 흑질에 철이 침착돼도 모든 사람이 퇴행성 신경질환을 앓지는 않는다. 축적된 철에 의한 독성에서 뇌세포를 보호하는 메커니즘이 존재하는 것이다. 권태준-조형준 교수팀은 이 메커니즘을 규명하기 위해 ‘늙은 쥐와 어린 쥐’의 자기공명영상(MRI)을 비교하고, 관련 유전자를 찾아 세포주 검증 실험을 진행했다.
늙은 쥐와 어린 쥐의 흑질 부분을 MRI로 촬영한 결과, 나이에 따라 흑질 부분에 철이 쌓인다는 게 정량적으로 확인됐다. 연구진은 해당 영역을 직접 채취해 유전자 발현 분석을 진행하고, 흑질에서 노화에 따라 발현량이 증가하는 유전자의 기능을 분석했다.
쥐의 뇌 조직을 이용한 유전자 분석에서는 ‘철의 농도가 높아지는 것에 대해 반응하는 유전자’뿐만 아니라 발달 및 노화 관련된 다양한 유전자가 함께 확인됐다. 연구진은 세포주 검증 실험을 통해 단백질 접힘 이상과 관련된 두 유전자(CLU, HERPUD1)가 철 농도가 높아지면 반응하는 것을 확인했다. 또 세포주에서 이들 유전자의 발현을 줄이자 철의 침착에 따른 세포 사멸이 늘어났다. 두 유전자의 발현이 노화에 따른 철의 침착에서 뇌세포를 보호하는 데 중요한 역할을 하는 것이다.
조형준 교수는 이번 연구에 대해 “철을 측정할 수 있는 자기공명기술(MRI)과 철에 대한 세포의 대응을 분자 수준에서 분석할 수 있는 기능 유전체 기술을 접목해 ‘노화에 따른 철의 침착과 관련된 새로운 유전자’를 찾을 수 있었다”고 설명했다.
권태준 교수는 “지금까지 퇴행성 신경질환 관련 연구와 비교하면, 나이가 들면서 자연스럽게 뇌 조직에 축적되는 철에 관한 연구는 부족했다”며 “이번에 발견한 유전자들이 노화와 관련된 퇴행성 신경질환과 철의 관계를 연구하는 데에 도움을 줄 것”이라고 기대했다.
이번 연구는 한국연구재단의 대학중점연구소지원사업과 글로벌박사 펠로우십, 한국보건산업진흥원의 보건의료연구개발사업과 울산과학기술원 미래선도형 특성화 사업의 지원을 받아 수행됐다. 연구결과는 와일리(Wiley)에서 출판하는 ‘에이징 셀(Aging Cell)’에 출판될 예정이며, 현재 온라인에 선공개돼 있다.