유전자 가위로 코로나바이러스-19 증식 차단 연구
|
기초과학연구원(IBS)은 코로나바이러스감염증-19(COVID-19‧이하 코로나19)와 코로나19의 원인인 사스-코로나바이러스-2(SARS-CoV-2 또는 2019-nCoV)에 대한 과학 지식과 최신연구 동향을 담은 <코로나19 과학 리포트>를 발행합니다. IBS 과학자들이 국내외 최신 연구동향과 과학적 이슈, 신종 바이러스 예방·진단·치료에 도움이 될 만한 연구진행 상황과 아이디어 등을 시민들과 공유하고자 합니다.
|
코로나-19(COVID-19) 확진자가 현재 10만 명을 넘어섰다. 무섭게 증식하면서 감염자를 늘리고 있는 코로나바이러스-19(SARS-CoV-2 또는 2019-nCoV)는 RNA(리보핵산) 계통의 바이러스다. 숙주의 세포에 자신의 RNA를 주입한 후 바이러스의 RNA를 복제하는 RNA 중합효소를 생산하여 개체수를 늘린다. 인간 세포에 침입한 바이러스 개체수가 증폭되면 감염병 증상이 뚜렷해지고 외부 전파 확률도 높아진다.
코로나바이러스-19의 RNA 복제를 차단한다면 효과적인 치료전략이 될 것이다. 미국, 중국에 이어 국내에서도 임상시험에 들어간 미국 제약회사 길리어드의 ‘렘디시비르(Remdesivir)’가 RNA 중합효소를 억제해 바이러스의 복제를 막는 치료 후보물질이다. 에볼라 바이러스 치료제로 임상시험이 진행되던 중 개발이 중단되었던 항바이러스제로 최근 새롭게 조명을 받고 있다. 바이러스의 RNA의 복제를 더 원천적으로 막을 수 있는 전략도 있다. 유전자 가위로 RNA를 잘라내고 파괴하는 것이다.
크리스퍼 유전자 가위는 어떻게 작동하나
유전자 가위는 생명체의 특정 유전물질을 인지하여 절단하는 인공 효소(단백질)다. 세포의 DNA 염기서열 특정부위를 잘라 내거나 다른 유전자로 교체할 수 있는 생명공학 기술이다. 유전질환을 일으키는 유전자를 교정하면 병을 근본적으로 치료할 수 있는데다, 농축산물의 성질을 쉽게 바꿀 수 있기 때문에 전 세계 생명과학자들이 치열하게 연구하고 있다. 가장 널리 활용되는 최신 기술이 ‘크리스퍼-카스(CRISPR-Cas system)’ 유전자 가위다.
박테리아가 자신을 공격하는 바이러스(박테리오파지)를 방어하려고 진화시킨 면역체계가 크리스퍼다. 박테리아는 침입자(바이러스)의 DNA정보를 자신의 DNA에 문신처럼 새겨 넣고(이 부위를 크리스퍼라 한다), 이 정보를 바탕으로 박테리오파지가 다시 공격해오면 적의 DNA를 찾아내 파괴한다. 박테리아는 침입자의 DNA를 추적하는 RNA를 만들어 표적(타깃)을 찾아내며, 이어 가위 역할을 하는 절단효소인 카스9 단백질로 적의 DNA를 잘라낸다.
인공적으로 만든 유전자 가위도 세균의 면역시스템과 마찬가지로 타깃을 찾는 가이드RNA와 절단효소로 구성된다. 절단 효소(단백질 가위)에 따라 크러스퍼 유전자 가위는 몇 가지 종류로 나뉘는데 크리스퍼-카스9(CRISPR-Cas9)이 대표적이다. 카스12, 카스13 등 다른 절단효소를 장착한 유전자 가위(크리스퍼-카스12, 크리스퍼-카스13)도 있다.
RNA 유전자 가위, 코로나바이러스-19 치료제 가능성
카스13은 DNA가 아니라 RNA를 표적으로 삼는 것이 특징이다. 2017년 미국 연구진은 RNA를 자를 수 있는 유전자 가위인 ‘크리스퍼-카스13’을 개발했다(Nature, 2017 550:280-284). RNA 유전자 가위가 등장한 이후 RNA형 바이러스를 퇴치할 수 있는 새로운 수단으로 주목받고 있다.
크리스퍼-카스13을 이용하면 코로나바이러스처럼 RNA로 증식하는 바이러스의 공격을 차단할 기능성이 있다. 2019년 유전자 가위로 RNA형 바이러스를 막을 수 있다는 논문이 발표되었다. 미국 연구진은 컴퓨터 시뮬레이션을 이용해 사람에게 감염을 일으킬 수 있는 수백 개의 단일가닥 RNA(ssRNA) 바이러스 중 크리스퍼-카스13으로 제거할 수 있는 바이러스를 탐색했다. 그 결과 A형 인플루엔자바이러스(IAV), 림프구성 맥락수막염바이러스(LCMV), 수포성 구내염바이러스(VSV) 등 3개의 바이러스에 효과가 있을 것으로 분석했고 이를 실험으로 증명하였다(Molecular Cell, 2019 76:826-837).
기초과학연구원(IBS) 유전체 항상성 연구단은 최근 이 아이디어에 착안해 크리스퍼-카스13으로 코로나바이러스-19의 증식을 차단할 수 있는 연구를 유니스트 교수진과 함께 진행하고 있다. 유전자 가위는 광범위하게 연구되고 있으나, 아직 사람의 질환치료에 직접 활용된 적은 없으므로 짧은 기간에 치료제로 개발되기는 어렵겠으나 근본적 치료법 중 하나가 될 수 있다.
바이러스 이용하여 바이러스 제압
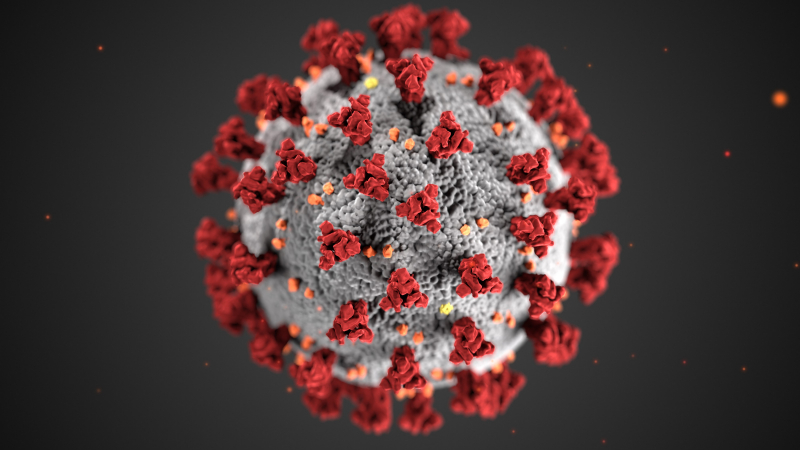
IBS 연구진은 코로나바이러스-19를 공격하기 위해 ‘이이제이(以夷制夷) 전략’을 적용할 계획이다. 오랑캐를 오랑캐로 제압하듯이 환자의 몸 안에 바이러스를 보내 바이러스를 잡는 치료기술이다.
연구진은 코로나바이러스-19의 RNA를 자르는 유전자 가위를 환자의 세포에 전달하기 위해 아데노부속바이러스(AAV·Adeno-Associated Virus)를 사용할 계획이다. AAV는 유전자 치료에 활용하는 바이러스성 운반체(Vector) 중 가장 안전하다고 알려져 있다. 유전자 치료 시 환자 몸으로 치료용 유전물질을 전달하는 운반체가 필수다. AAV와 같은 바이러스성 물질이 그 역할을 한다. AAV에 크리스퍼-카스13을 실어 감염 부위 세포에 성공적으로 운반하면, 세포 안에서 합성된 가이드RNA가 바이러스를 찾아내고, 카스13이 침입자의 RNA를 잘라버리는 순서로 진행된다. AAV에 가이드 RNA와 카스13의 유전정보가 실리며, 실제 합성은 AAV가 세포 안에 들어간 뒤 일어난다. 카스13을 완성된 단백질 형태로 전달하는 방법도 있다.
게다가 AAV는 코로나바이러스-19가 감염을 일으키는 부위인 폐에 잘 진입하는 운반체여서 크리스퍼-카스13 유전자 가위를 안전하게 수송하는데 안성맞춤이다. 환자의 폐 세포 안에서 생산된 유전자 가위들이 코로나바이러스의 RNA를 자르고, 결과적으로 바이러스의 증폭을 막을 수 있다.
미국과 이탈리아 공동연구팀도 지난 2월 18일 크리스퍼-카스13 유전자 가위를 이용한 치료법 개발에 나섰다고 밝혔다. 연구팀은 코로나-19 환자 19명의 RNA 유전정보를 분석했으며, 바이러스를 복제하는 유전정보를 담고 있는 부위와 스파이크 단백질에 관여하는 부위를 동시에 표적으로 삼는 유전자 가위를 사용할 것이라고 밝혔다. 연구진에 따르면 크리스퍼-카스13은 가이드 RNA를 손쉽게 디자인할 수 있는 특징이 있으며, 이에 따라 코로나바이러스-19의 다양한 염기서열을 목표로 삼으면서 인간 유전체에는 영향을 주지 않는 가이드RNA 1만333개를 설계했다. 이 연구팀도 유전자가 가위를 세포 속까지 전달하는 수단으로 AAV를 사용한다.(Cell Research, 2020 Editorial)
코로나바이러스-19를 퇴치하려면 백신 개발이 급선무다. 다행히 3차원 단백질 구조가 규명되고, 몇몇 기업에서 임상시험에 돌입한다는 기쁜 소식도 전해진다. 백신 개발과 더불어 감염된 환자를 치료할 수 있는 치료제 개발 역시 필요하다. 임상시험 중인 후보물질 중에서 효과적인 치료제가 신속히 나오길 기대한다. 코로나 바이러스와 같은 RNA형 바이러스는 변이를 쉽게 하므로 기존 약물의 포위망을 빠져나갈 수 있다. 변신에 능한 RNA 바이러스에 대항하려면 바이러스 유전자의 여러 부위를 공격할 수 있는 RNA 유전자 가위가 대안이 될 수 있다. 다만 유전자 가위는 여러 단계를 거쳐야 환자에 적용할 수 있다. 유전자 가위를 탑재한 AAV를 개발한 뒤 치료법 개발을 위해 여러 전문가들의 협조가 필요하다. 바이러스 연구자, 임상적 안정성을 시험할 의료인, 안전한 치료제를 대량생산할 수 있는 기업이 모두 힘을 합쳐야 새로운 치료전략을 실현할 수 있을 것이다.
|
본 글의 저작권은 기초과학연구원에 있습니다. 공유 및 재사용 시에는 출처를 명시해주시기 바랍니다.
|
IBS 커뮤니케이션팀에서는 ‘코로나19 과학리포트’에 재능을 기부해주실 과학자를 찾습니다. 관심 있는 분은 dreamer@unist.ac.kr 로 연락주시면 연결해 드리겠습니다.










![[경상시론]코닥 이야기: 성공의 열쇠, 성공의 역설](https://news.unist.ac.kr/kor/wp-content/uploads/2026/02/kodaq-190x122.jpg)


