퇴행성 뇌질환 유전자인 ‘어택신-투(Ataxin-2)’는 생체리듬을 조절하는 ‘생체시계 유전자’로도 작용한다. 최근 UNIST 연구진이 어택신-투와 결합하는 새로운 생체시계 유전자와 그 작용원리를 밝혀 주목받고 있다. 루게릭병의 발병 원인과 치료 연구에도 중요한 단서가 될 전망이다.
임정훈 생명과학부 교수팀은 어택신–투가 생체리듬을 조절하는 정교한 분자생물학적 원리를 세계 최초로 규명하여 ‘몰레큘러 셀(Molecular Cell)’ 6일자에 발표했다. 몰레큘러 셀은 생화학 및 분자생물학 분야의 최고 권위의 학술지이다.
어택신-투 유전자의 돌연변이는 루게릭병, 척수소뇌실조증, 파킨슨병 등과 같은 퇴행성 뇌질환의 중요한 유전적 요인으로 작용한다. 하지만 노화에 따른 신경세포 사멸과 퇴행성 뇌질환 발병을 조절하는 ‘어택신-투 단백질 복합체’의 분자생물학적 작용 원리에 대해서는 알려진 바가 없다.
임정훈 교수는 2011년 네이처(Nature)와 2013년 사이언스(Science)에 발표한 연구를 통해 생체시계 유전자인 피어리어드(period) 단백질 합성에 필요한 새로운 유전자 트웬티-포(twenty-four)를 발견하고, 어택신-투가 트웬티-포 단백질의 번역 활성화 기능을 촉진함으로써 수면 주기와 같은 24시간 주기의 일주기성 동물 행동을 조절한다는 생체시계의 작동원리를 규명한 바 있다. 피어리어드는 최초로 밝혀진 생체시계 유전자로 이 유전자를 조작하면 생체리듬에 이상이 생긴다.
이번 연구에서는 어택신–투 단백질과 결합하는 두 개의 새로운 단백질에 대한 유전자(Lsm12, me31B)를 발견하고, 각 단백질의 결합에 따라 달라지는 어택신–투 단백질 복합체의 생체리듬 조절 원리를 밝혀냈다. 이러한 분자생물학적 작용 원리 규명에는 형질전환 초파리의 행동신경 유전학적 모델이 활용됐다.
엘에스엠–트웰브 단백질은 어택신-투와 트웬티-포 단백질을 연결시키는 분자 어댑터로 작용한다. 그 결과 생체시계 유전자인 피어리어드 단백질 번역을 활성화시키고, 생체리듬이 24시간의 주기성을 가지도록 만든다. 반면 엠이써티원비 단백질은 어택신-투 단백질과 결합해 단백질 번역의 재료인 전령 RNA를 분해하는 낫원(Not1) 단백질 기능을 활성화시킨다. 그 결과 생체리듬을 조절하는 물질(신경 펩타이드)의 분비 시기를 조절해 수면 등 생체리듬의 주기를 지속시키는 역할을 한다.
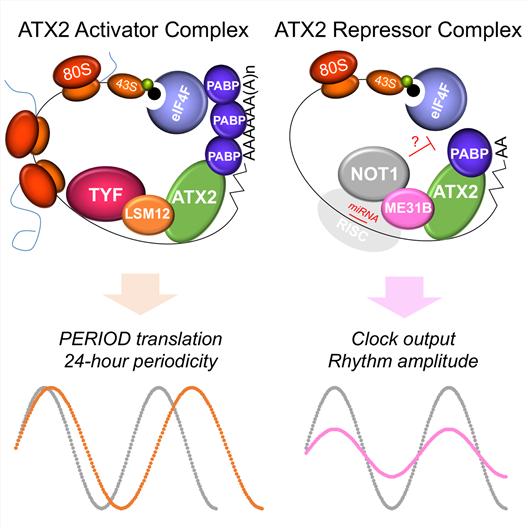
임 교수팀이 찾아낸 어택신-투 단백질 복합체의 모습과 기능. 엘엠에스-트웰브는 하루를 24시간으로 인식하도록 만들고, 엠이써티원비는 생체시계가 꾸준히 작동하도록 에너지를 주는 시계태엽 같은 역할을 한다.
이번 연구에 공동 제1저자로 참여한 이종보 생명과학부 석․박사통합과정 연구원은 “어택신-투 단백질 복합체는 생체시계를 조절하는 신경세포 내에서 특이적으로 작용한다”며 “어택신-투 단백질 복합체가 어떤 구성이냐에 따라 생체시계 유전자의 발현과 수면주기 조절이 전혀 다르게 이뤄진다”고 설명했다.
임정훈 교수는 “이번 연구는 루게릭병과 같은 퇴행성 뇌질환 발병 원인을 이해하는 근본적인 분자생물학적 모델을 확립했다는 데 의미가 있다”며 “이런 결과를 토대로 어택신-투 단백질 복합체가 어떤 세포생물학적 경로를 통해 루게릭병의 발생에 기여하는지 구체적으로 연구하고 있다”고 밝혔다.
이번 연구는 UNIST 생명과학부 석․박사통합과정 이종보, 유은석, 이호연 연구원이 공동 제1저자로 참여했다. 연구 지원은 미래창조과학부/한국연구재단의 신진연구지원사업과 보건복지부/한국보건산업진흥원의 질환극복기술개발사업(질병중심 중개기반연구)을 통해 이뤄졌다.

















![[2025 학위수여식] “과학기술과 사회 잇는 리더로 거듭나길”… 학위수여식 개최](https://news.unist.ac.kr/kor/wp-content/uploads/2025/02/2025학년도-UNIST-학위수여식이-20일-실내체육관에서-열렸다-107x60.jpg)

