염색체 복제 및 손상 복구 과정의 종료에 관여하는 단백질의 핵심 작동원리가 밝혀졌다. UNIST 생명과학부 명경재 특훈교수(IBS 유전체 항상성 연구단장), 김하진 교수팀과 유전체 항상성 연구단 강석현 연구위원팀은 과 공동으로 염색체 복제가 끝나면 DNA와 결합했던 PCNA(증식성세포핵항원)*가 ATAD5-RLC 단백질**에 의해 분리되는 메커니즘을 분자 수준에서 규명했다.
*PCNA(Proliferating Cell Nuclear Antigen, 증식성세포핵항원) : DNA에 결합하여 염색체 복제를 도와주는 단백질. 염색체 복제 과정에서 여러 효소를 끌어와 복제를 돕고, 복제가 끝난 뒤 DNA와 분리된다.
**ATAD5-RLC 단백질 : 염색체 복제 과정이 끝나면 DNA로부터 증식성세포핵항원이 분리되는 것을 도와주는 단백질.
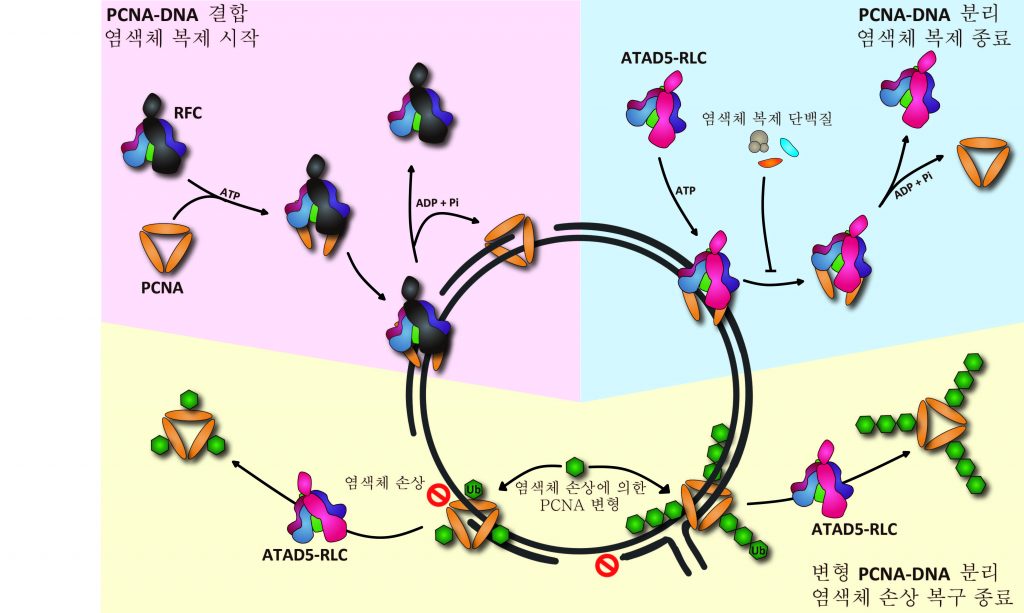
증식성세포핵항원(PCNA)과 DNA의 결합 및 분리 메커니즘을 표현한 그림
염색체 복제는 생명체의 유지와 유전정보 전달을 위한 필수 대사과정이다. 염색체 복제는 DNA 생성에 관여하는 단백질들이 DNA와 결합하는 것을 신호탄으로 시작된다. 그중 고리 형태의 단백질인 PCNA는 바늘구멍에 실을 꿴 모양으로 DNA와 결합하여 염색체를 복제하고 손상된 염색체를 복구하는데 주도적인 역할을 한다. 이 과정이 끝나면 PCNA가 DNA와 분리되면서 염색체 복제 과정이 종료된다.
문제는 제때 분리되지 않고 계속 결합된 상태로 있는 경우다. 명경재 단장 연구팀은 이전 연구*를 통해 이미 PCNA가 DNA에서 정상적으로 제거되지 않을 경우 오히려 염색체에 돌연변이를 일으키고, 암이 유발될 수 있음을 생쥐 모델 실험으로 밝힌 바 있다. 하지만 PCNA가 임무를 끝낸 뒤 DNA에서 떨어져 나가는 원리는 제대로 밝혀지지 않았다.
*Lee, K. Y., Fu, H., Aladjem, M. I. & Myung, K. ATAD5 regulates the lifespan of DNA replication factories by modulating PCNA level on the chromatin. J. Cell Biol. 200, 31–44 (2013).
연구진은 ATAD5-RLC 단백질이 DNA와 PCNA의 분리에 관여할 것으로 예측하고, 이를 규명하기 위해 연구를 시작했다. PCNA와 DNA의 결합 및 분리를 추적할 수 있는 실험법과 실시간으로 결합 및 분리를 관찰할 수 있는 단분자 형광 이미징 실험법*을 고안해냈다.
*단분자 형광 이미징 실험법(single molecule fluorescence imaging) : 각각의 단분자들을 형광물질로 표지하여 각 분자의 상호작용을 현미경 하에서 실시간으로 분석하는 방법.

강석현 IBS 유전체 항상성 연구단 연구위원(윗줄 왼쪽 세 번째), 김하진 UNIST 생명과학과 교수(윗줄 오른쪽 두 번째)와 참여 연구진의 모습. | 사진: 김경채
이를 통해 ATAD5-RLC 단백질이 PCNA의 닫힌 고리를 열어 DNA로부터 분리시킴으로써 염색체 복제를 종료시키는 생화학적 메커니즘을 규명하고, PCNA의 분리에 필요한 ATAD5-RLC의 구조적 특성을 알아냈다. 또한 ATAD5-RLC 단백질이 정상적인 염색체 복제 종료 뿐 아니라 염색체 손상에 의해 변형된 PCNA*도 DNA로부터 분리시켜 염색체 손상 복구 종료에도 관여함을 밝혔다.
*PCNA는 염색체 손상 시 변형되어 염색체 손상 복구를 유도한다.
이번 연구는 염색체 복제 과정 및 손상 복구 과정이 정상적으로 종료되게 하여 유전 정보의 변형이 일어나지 않도록 조절하는 메커니즘을 밝혔다는데 의의가 있다.
명경재 단장은 “증식성세포핵항원과 DNA의 결합 및 분리는 생명체의 필수 대사과정인 염색체 복제를 이해하기 위해 중요한 정보로, 이번 연구로 인해 생명의 근원을 이해하는 데 한 걸음 다가가게 됐다”며 “염색체 복제가 정확하게 종료되지 않으면 암과 같은 질환이 발생할 수 있는 만큼, 이번 연구가 유전 정보의 이상으로 발생하는 질환의 근본적인 원인을 규명하고 궁극적인 치료법을 개발하는 데 기여할 것으로 기대한다”고 말했다.

명경재 생명과학부 특훈교수(IBS 유전체 항상성 연구단장) | 사진: 안홍범
이번 연구성과는 네이쳐 커뮤니케이션즈(Nature Communications, IF 12.35) 6월 3일 18:00(한국시간)자 온라인 판에 실렸다.
*본 연구 성과 보도자료는 IBS 커뮤니케이션팀 주관으로 작성되었습니다.(바로가기)