UNIST 생명과학부 이자일 교수팀과 KAIST 송지준 교수 공동 연구팀이 암세포에서 많이 생성되고, 암의 예후를 악화시키는 것으로 알려진 단백질의 구조를 규명했다. 세포 내 DNA 사슬 구조 조절에 관여하는 단백질의 구조와 작동기작이 밝혀지면서 암 치료를 위한 신약 발굴이 가속화될 것으로 기대된다.
사람의 DNA 사슬은 매우 긴 길이를 갖고 있다. 이 때문에 DNA는 실패에 감긴 실처럼 특정 단백질을 중심으로 압축돼 세포 핵 속에 들어가 있다. 이 실패 역할을 하는 단백질이 바로 히스톤이다. 히스톤은 DNA와 결합해 응축된 유전체 구조를 형성하고, DNA의 활성을 조절한다.
히스톤을 조절하면 DNA의 유전정보를 복제하거나, 유전정보를 읽어 단백질을 만드는 과정에서 DNA 사슬을 느슨하게 또는 팽팽하게 조절할 수 있다.
문제는 이러한 역동적인 DNA 사슬 조절 과정에서 히스톤이 뭉치거나 DNA 사슬이 얽힐 때 발생한다. 유전정보가 손실되거나 무분별한 유전자 발현이 발생해 발생학적 질환이나 암으로 이어질 수 있기 때문이다.
이를 제어하고 조절하는 단백질이 바로 히스톤 샤페론이다. 이 단백질은 히스톤의 뭉침이나 원하지 않는 DNA 사슬의 엉김을 방지하는 역할을 통해 DNA 사슬과 관련된 과정을 올바르게 작동할 수 있도록 돕는다.
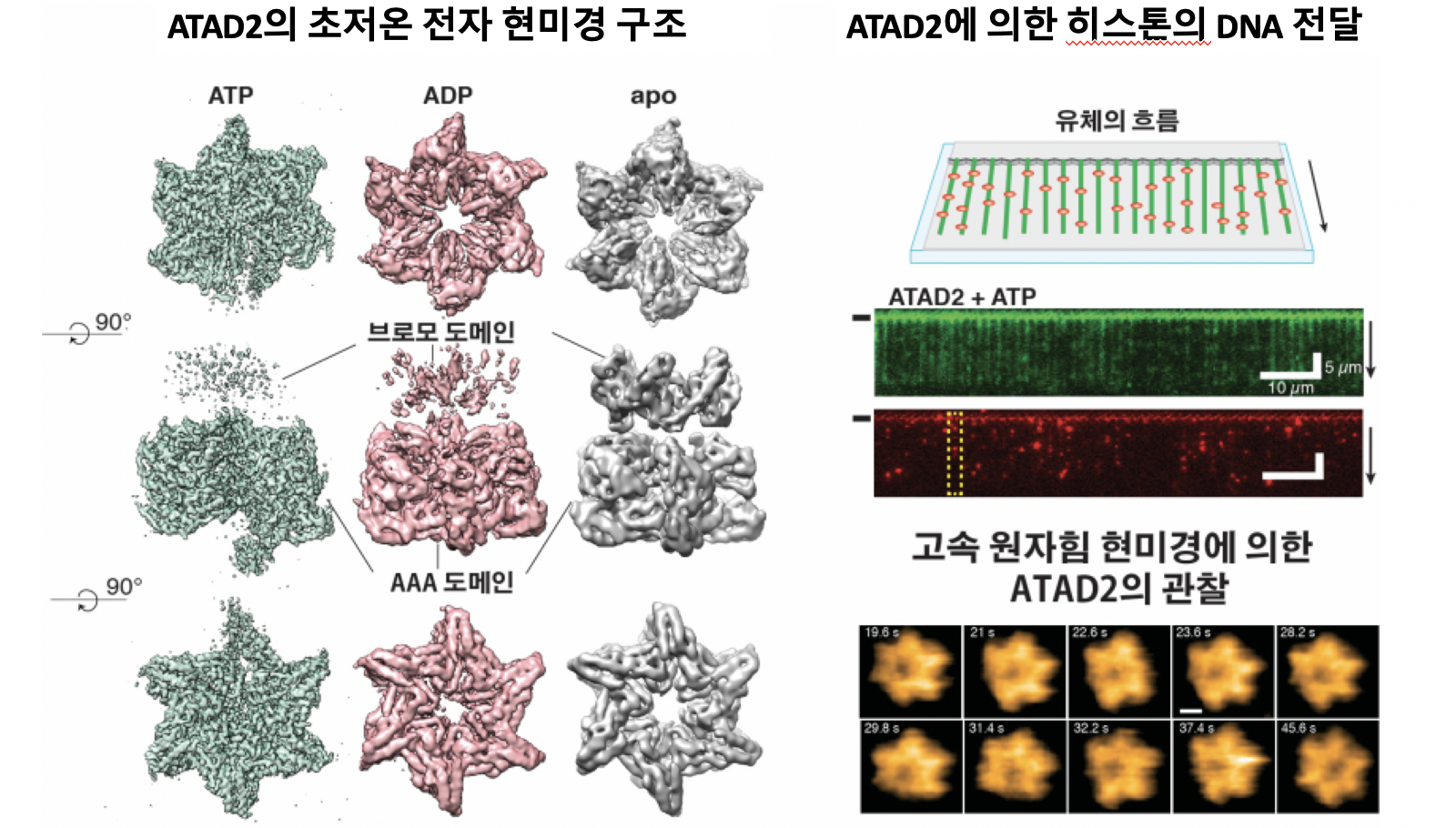
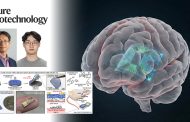
ATAD2의 구조와 분자기작 관찰 결과
연구진은 이러한 히스톤 샤페론 중 하나인 ATAD2에 집중해 연구를 진행했다. ATAD2는 여러 암세포에서 많이 발견되며, ATAD2가 높게 발현된 종양은 악성일 확률이 높고 그 환자들의 예후가 좋지 않다는 특성을 보이고 있다. 이에 이 단백질을 표적으로 한 치료제 개발 및 임상 연구가 활발히 진행되고 있는데, 현재까지 구조나 기능에 대한 구체적인 정보는 알려진 바가 없었다.
연구팀은 단백질과 같은 생체분자를 자연적인 상태대로 볼 수 있는 초저온 전자현미경을 이용해 ATAD2 단백질의 구조를 규명했다. 연구 결과 ATAD2는 ATP를 ADP로 분해하며 생성되는 에너지를 이용해 나선형 구조에서 고리형 구조로 변형된다는 것이 밝혀졌다.
연구진은 이와 함께 생체분자의 표면을 그려내는 고속원자힘현미경(AEM)을 이용해 ATAD2의 구조 변화 과정을 실시간으로 관찰하는데도 성공했다. 고리 구조 중앙에 히스톤이 결합하며, 이 결합이 ATAD2가 히스톤을 DNA에 전달하는데 필수적인 역할을 한다는 것이 실험적으로 입증된 것이다.
이자일 교수는 “이번 연구는 초저온전자현미경과 같은 첨단 생물리학적 기법을 이용해 히스톤 샤페론 단백질의 구조와 작용기전을 밝혔다는데 그 의미가 있다”며 “이번 성과를 바탕으로 ATAD2를 표적으로 하는 신약 후보 물질의 발굴이 가속화 될 것으로 기대한다”고 밝혔다.
한편 이번 연구는 과학기술정보통신부의 중견연구지원사업 등의 지원을 받아 수행됐으며, 국제학술지 네이처 커뮤니케이션(Nature Communications)에 12월 17일자 게재됐다.