일반 항암치료에서는 암세포만이 아니라 정상세포도 함께 공격하는 부작용이 나타난다. 따라서 암세포만 선택적으로 제거하는 새로운 항암치료 연구가 활발한데, ‘나노입자의 결정화’라는 현상을 이용해 암세포만 골라 죽이는 방법이 나와 주목받고 있다.
UNIST(총장 이용훈) 자연과학부의 바르토슈 그쥐보프스키 특훈교수(IBS 첨단연성물질연구단 그룹리더)가 이끄는 연구팀은 ‘표면에 전하를 띠는 리간드(Ligand)가 부착된 금속 나노입자’를 이용해 암세포만을 선택적으로 파괴할 수 있음을 증명했다. 이 나노입자는 정상세포와 암세포 속에 모두 있는 ‘리소좀(Lysosome)’ 내부로 침투하는데, 암세포에서만 커져서 리소좀을 망가뜨리고 세포를 죽인다. 같은 물질을 투입해도 암세포는 죽고 정상세포는 사는 것이다.
리소좀은 세포 내에서 ‘재활용 쓰레기통’ 역할을 하는 주머니 형태의 기관이다. 세포에서 못 쓰게 된 다른 기관을 분해해 다시 단백질을 만들거나, 바이러스 같은 외부 물질을 파괴하는 활동도 모두 이곳에서 일어난다. 그런데 리소좀 주머니 벽이 파괴되면 안에 있던 ‘쓰레기’들이 새어나오면서 세포가 파괴된다. 이 현상을 암세포에서만 나타나게 하는 항암제 연구가 시도됐으나, 아직은 정상적인 세포에도 영향을 주는 문제가 있었다.
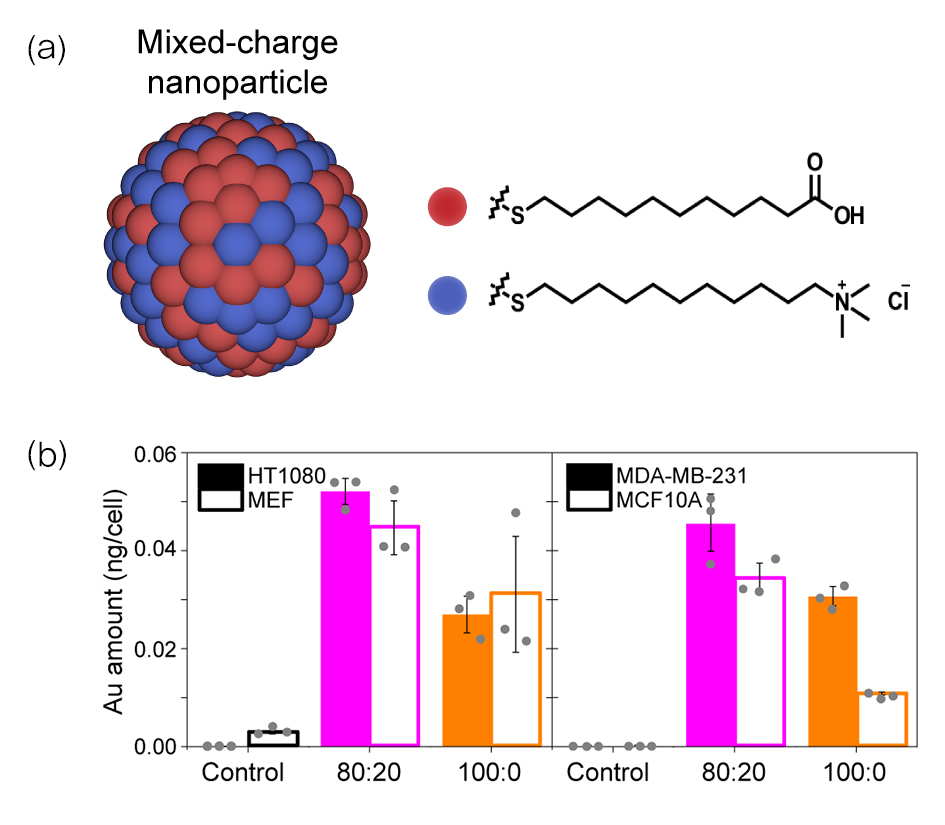
바르토슈 그쥐보프스키 교수팀은 암세포 주변이 산성(Acidic)이라는 점에 착안해, 이런 환경에서 결정화 현상이 달라지는 나노입자를 설계함으로써 기존 문제를 해결했다. 암세포에서만 결정이 커지는 나노입자가 있다면, 암세포 속 리소좀으로 흡수된 뒤 리소좀을 파괴하고 세포 사멸까지 이끌 수 있다고 본 것이다. 연구팀은 금(Au) 나노입자 표면에 양전하와 음전하를 각각 띠는 꼬리 모양 물질(리간드)을 특정 비율로 붙였다. 이 물질은 산성에서 결정이 점점 더 커지는 특성을 가지는데, 정상세포와 암세포에 주입하자 암세포만 선택적으로 사멸됐다.
공동교신저자인 크리스티아나 칸델-그쥐보프스카 IBS 연구위원은 “암세포는 산성을 띠므로 나노입자가 잘 뭉치는 데다, 암세포는 그 기능이 비정상적이라 큰 결정으로 자란 나노입자를 배출하기 힘들어 결국 사멸한다”며 “암세포 선택성을 극대화하려면 리소좀으로 나노입자들이 잘 운반돼야 하는데, 나노입자 표면의 양이온과 음이온 비가 8대 2일 때 덩어리 크기가 적당해 잘 운반됐고, 사멸 효과도 높았다”고 설명했다.
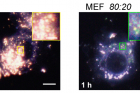
세포 내 나노입자의 움직임은 ‘암시야현미경’(Dark-field Microscopy) 같은 특수기법으로도 확인됐다. 이 분석을 주도한 조윤경 UNIST 생명과학부 교수(IBS 그룹리더)는 “나노입자 하나의 크기가 단백질 분자 수준으로 작아서 관찰이 까다로운 연구”라며 “혹시 관찰을 위한 꼬리표를 붙이면 양이온과 음이온의 황금비율(8대 2)을 해칠 우려가 있어 특수한 관찰법이 필요했다”고 전했다.
연구진은 또 거대한 나노입자 결정을 품은 암세포의 리소좀 내부에서는 세포 성장을 담당하는 신호 단백질(mTORC1)의 작용이 억제되는 현상을 발견했다. 이 단백질은 정상세포에서 더 활성화된다. 따라서 해당 단백질이 리소좀 벽의 파괴와 암세포 사멸에 영향을 줬다고 예상할 수 있다.
바르토슈 그쥐보프스키 교수는 “‘고장난 암세포의 특징’, 즉 세포 주변이 산성이고 이물질 배출도 어렵다는 점을 역으로 활용해 암세포를 죽일 수 있다는 점에서 흥미롭다”며, “앞으로 동물실험을 진행해 항암치료제로서 가능성을 추가로 살필 것”이라고 연구계획을 밝혔다.
그는 이어 “나노입자에 리간드를 붙여 선택적으로 입자의 뭉침을 유도하는 방법은 금속 나노입자뿐 아니라 고분자 나노 기반 입자 등에도 적용할 수 있다”며 “이번 연구는 나노입자 과학의 관점에서도 큰 의의가 있다”고 전했다.
한편 이번 연구는 기초과학연구원(IBS)에서 지원했으며, 세계적인 과학 학술지 네이처 나노테크놀로지(Nature Nanotechnology) 3월 16일자에 게재됐다.
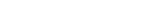


![[연구그림] 정상세포와 암세포에서 세포 내 섭취작용을 통해 흡수된 금속 나노입자의 거동비교](https://news.unist.ac.kr/kor/wp-content/uploads/2020/04/연구그림-정상세포와-암세포에서-세포-내-섭취작용을-통해-흡수된-금속-나노입자의-거동비교.jpg)