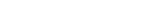생명체 대부분을 구성하는 물은 몸속 단백질의 구조와 기능에 영향을 준다. 생체 기능을 담당하는 효소나 호르몬 같은 물질도 단백질이므로 몸속 물의 특성을 알면 질병 원인 파악이나 신약 개발에 큰 도움이 된다. 최근 이런 일을 가능케 할 기술이 발표됐다.
UNIST(총장 이용훈) 자연과학부의 권오훈 교수팀은 레이저 빛을 받으면 ‘주변 물에서 수소 이온(H⁺, 양성자)을 뺏는 분자’를 이용해 생체 속 물(Biological water)이 가진 ‘수소 결합 에너지’를 분석하는 방법을 개발했다. 단백질 주변에 있는 물의 수소 결합 에너지를 측정할 수 있으므로, 그 구조와 기능 변화에 어떤 영향을 주는지도 파악할 수 있다. 이번 연구는 UNIST 에너지 및 화학공학부의 곽상규 교수팀과 아주대(총장 박형주) 응용생명화학공학과의 유태현 교수팀이 함께 진행했다.
수소 결합(Hydrogen bond)은 수소와 결합한 분자 주변에 나타나는 전기적 끌어당김이 만든 화학결합이다. 물 분자끼리의 연결이나 생체고분자의 구조를 결정하는 데에 이 결합이 중요한 역할을 한다. 수소 결합은 분자 사이에 작용하는 힘이므로 물에 둘러싸인 생체고분자의 구조에도 영향을 줘 기능을 바꾸게 된다. 따라서 생체고분자의 구조와 기능을 이해하려면 특정 위치에서 물의 수소결합 에너지를 아는 게 중요하다. 하지만 생체고분자는 수많은 물 분자 속에 둘러싸여 원하는 위치에서 영향을 주는 물 분자들의 수소 결합 에너지를 측정하기 어렵다.
생체 속 물 분자의 수소 결합 에너지를 파악하기 위해 공동연구팀은 빛을 받아 들뜬 상태(Excited state)가 되면 주변 ‘물 분자의 수소 이온(H⁺)를 탐내는 분자(7-아자트립토판)’를 활용했다. 이 분자가 물 분자의 수소 이온을 빼앗을 때 주변 물의 수소 결합이 끊어졌다가 재배치되는데, 그 반응 속도를 보고 물 분자의 수소 결합 에너지를 추론한 것이다. 7-아자트립토판이라는 물질은 들뜬 상태에서 이웃한 물 분자에서 수소 이온을 뺏고, 자신의 수소 이온을 다시 물 분자에게 준다. 이 과정에서 물 분자간 수소 결합은 끊어졌다가 재배치된다. 물 분자간 수소 결합 세기가 클수록 결합을 끊는데 오랜 시간이 걸려 반응 속도가 느리다.
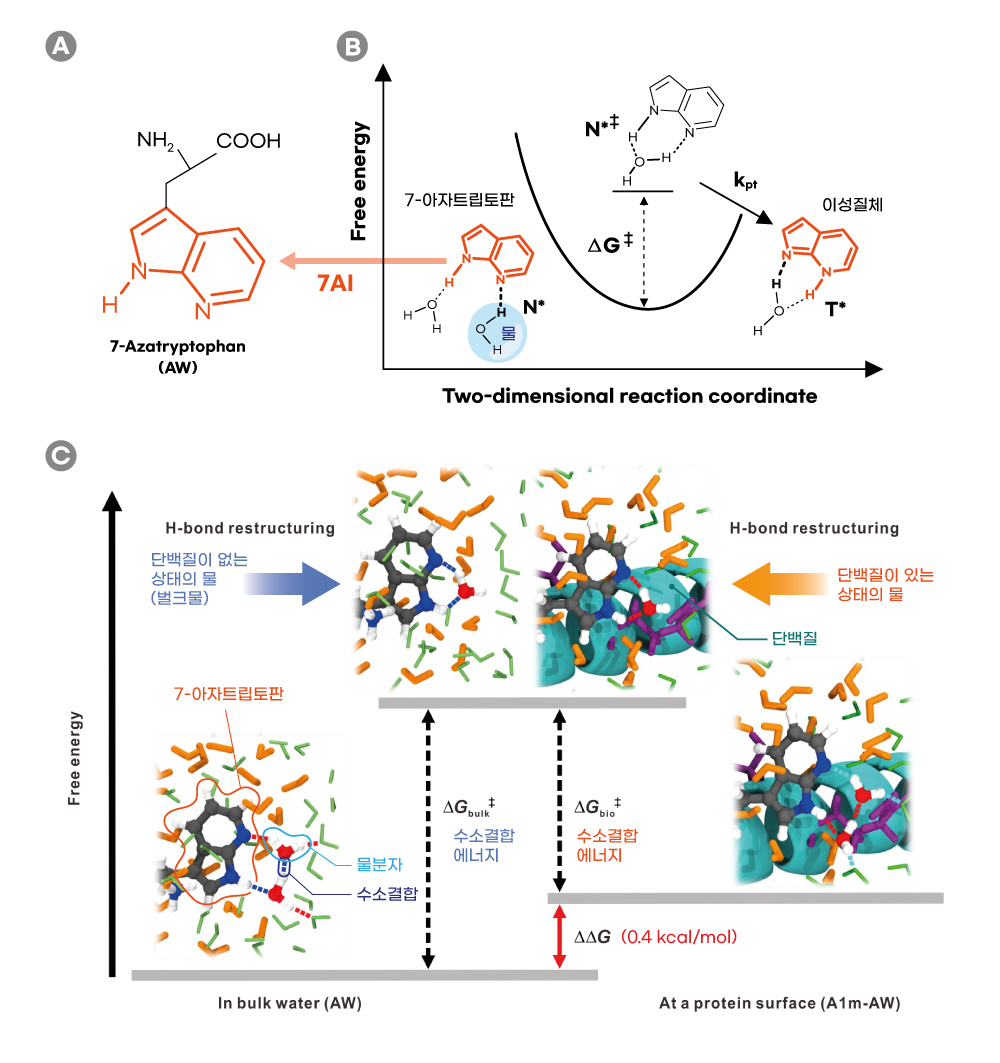
연구팀은 7-아자트립토판을 이용한 인공단백질을 합성해 이 내용을 검증했다. 우선 7-아자트립토판이 들뜬 상태에서 방출하는 빛을 피코초(Picosecond, 10억 분의 1초) 단위로 측정하는 분광법을 이용해 반응 속도를 구했다. 그 결과 단백질 주변에서 물의 수소결합 에너지는 단백질이 없는 상태보다 낮게 나타났다. 단백질 주변의 물은 수소결합 에너지가 작아서 더 쉽게 끊어지는 것이다. 이는 컴퓨터 시뮬레이션으로 계산한 결과와도 일치했다.
제1저자인 박원우 UNIST 화학과 박사과정 연구원은 “‘7-아자트립토판을 들뜨게 만드는 레이저’와 ‘수소 이온 교체 전 반응물과 교체 후 생기는 생성물이 내뿜는 빛을 감지하는 탐침 시스템’이 하나로 결합된 ‘여기–탐침 방식’을 이용해 반응이 일어나는 찰나를 포착할 수 있었다”고 설명했다.
권오훈 교수는 “이번 연구를 통해 생체 속 특정 영역에서 물의 수소결합 에너지를 도출하는 실험적 방법론을 제시했다”며 “생체고분자인 단백질의 구조나 접힘을 파악하고, 단백질-리간드(ligand) 결합과 같은 수많은 생물학적 현상에서 생체 속 물의 역할을 추적하는 데에 활용할 수 있어 신약 개발 등에 도움을 줄 것”이라고 기대했다.
이번 연구는 화학 분야 최상위 저널인 ‘앙게반테 케미(Angewandte Chemie International Edition)’에 주목 받는 논문(Hot Paper)이자 표지 논문(Back Cover)으로 동시에 선정돼, 4월 27자로 출판됐다 . 연구 수행은 과학기술정보통신부와 한국연구재단, 기초과학연구원(IBS), 교육부의 지원을 받아 이뤄졌다.