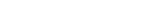유방암이 간에 전이되는 과정이 새롭게 밝혀졌다. 인간의 간을 모방한 ‘3D 간 칩’을 이용한 덕분이다. 이번 발견은 암 전이를 조기 진단하거나 환자 맞춤형 진단·치료법 개발에 기여할 것으로 기대된다.
UNIST (총장 이용훈) 바이오메디컬공학과의 조윤경 교수 (IBS 첨단연성물질연구단 그룹리더)팀은 ‘3D 간 칩’(Liver-on-a-Chip)을 이용해 암 전이 과정에서 나노소포체의 역할을 규명했다. 나노소포체는 세포가 배출하는 나노미터(1nm, 10-9) 수준의 ‘행낭’이다. 세포들은 소포체 안에 각종 단백질 정보를 담아 서로 소통한다. 암세포 역시 나노 소포체를 배출한다. ‘암세포에서 배출된 나노 소포체가 전이에 중요한 역할을 한다’는 가설이 있었지만 복잡한 생체 내에서 이를 직접 검증하기는 어려웠었다.
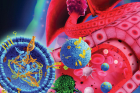
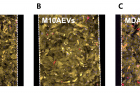
연구팀은 이 가설을 검증하기 위해 간세포가 배양된 칩을 이용했다. 유방암에서 나온 나노소포체는 간의 혈관벽을 더 끈끈하게 해 ‘유방암 씨앗’(순환 종양 세포)이 혈관벽에 3배 이상 더 잘 달라붙게 만들었다. 나노소포체 표면의 종양성장인자(TGFβ1)가 혈관벽 ‘끈끈이 단백질’인 파이브로넥틴(Fibronectin) 양을 증가시키기 때문이다.
조윤경 교수는 “장기에 암 세포가 뿌리내리기 좋은 환경이 조성돼 전이가 잘 발생한다는 ‘토양과 씨앗’ 가설이 이번 연구로 힘을 얻게 됐다”며 “나노소포체는 이 과정에 토양을 비옥하게 만드는 ‘비료’ 역할을 하는 셈”이라고 설명했다.
이번 연구에 제1저자로 참여한 김준영 UNIST 생명과학부 박사는 “장기-온-어-칩(Organ-on-a-Chip) 기술’을 나노소포체에 의한 암 전이 과정을 이해하는 데 최초로 적용”했다며 “간을 구성하는 다양한 세포를 함께 배양해 인체 간 조직과 유사 할 뿐만 아니라 혈액을 흘려보낼 수 있어 혈액 속에 포함된 나노소포체의 역할을 제대로 이해할 수 있다”고 설명했다.
연구팀은 유방암 외에도 간 전이가 잘 발생하는 암, 간 전이가 발생하지 않는 암, 건강한 사람의 나노소포체 등을 대조군으로 써 위와 같은 사실을 구체적으로 입증했다. 간 전이가 잘 발생하는 췌장암 유래 나노 소포체는 유방암 유래 나노소포체와 동일한 효과를 보였다. 또 간 전이가 발생한 유방암 환자는 간 전이가 발생하는 않은 유방암 환자나 정상인보다 나노 소포체의 종양성장인자 발현양이 많았는데, 이는 나노 소포체의 종양성장인자 발현과 순환종양세포의 접착 수 증가 간 연관성을 보여준다.
조 교수는 “유방암의 간 전이과정에 대한 이해를 바탕으로 간 전이 빈도가 높은 췌장암, 대장암 등의 전이 과정도 밝혀 낼 수 있을 것”이라며 “간은 전이암 발생빈도가 매우 높고, 전이 암 발생 시 사망률이 급격히 증가한다는 점을 고려한다며 이번 연구의 의미가 크다”고 전했다.
이번 연구는 아산 병원의 이희진 교수팀과 함께 진행됐다. 연구 수행은 기초과학연구원(IBS) 및 한국연구재단의 지원을 받아 이뤄졌다. 연구 성과는 ‘ACS Nano’ 표지논문으로 선정돼 11월 24일에 출판됐다.