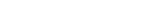대장암을 면역 항암제로 치료할 수 있는 새로운 길이 열렸다.
바이오메디컬공학과 이세민 교수 연구팀은 대장암에 적용할 수 있는 저분자 면역항암제 후보물질의 작용 매커니즘을 규명했다. 연구팀은 이 물질의 항암 매커니즘이 기존 면역 항암제와 달라, 둘을 병용하면 대장암 치료 효과를 높일 수 있을 것으로 기대했다. 이번 연구는 한국화학연구원 신약기반기술연구센터 이창훈 박사팀과 함께했다.
면역 항암제는 우리 몸의 면역 세포가 암세포를 공격하도록 돕는 치료제다. 암세포는 면역 세포 공격을 피하기 위해 ‘면역체크포인트 단백질’을 활용하는데, 면역항암제가 이들 단백질의 작용을 억제하는 원리다. 약물이 암세포를 직접 공격하는 기존 항암제와의 차이점이다. 이 때문에 부작용이 적고 치료 효과가 오래간다는 장점이 있다.
하지만 면역항암제의 치료 효과는 암 종류나 환자 개인에 따라 편차가 크다. 암세포가 발현 하는 단백질 종류나 작용방식이 암 종류와 환자에 따라 다르기 때문이다. 특히 대장암은 면역항암제가 잘 듣지 않는 것으로 알려져 있다.
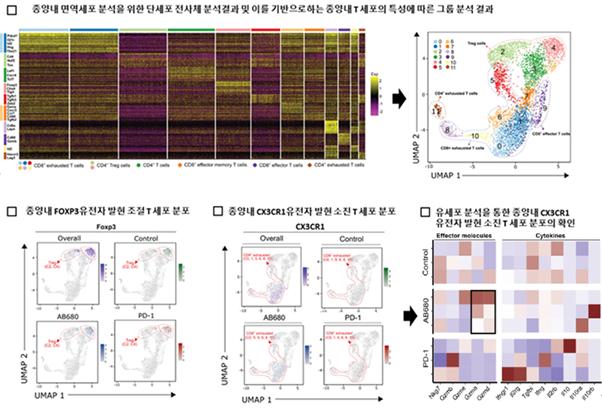
이세민 교수팀은 대장암에 저분자 면역항암제 후보 물질인 ‘CD73 단백질 억제제’를 적용하고, 그 결과를 기존 항체 기반 면역항암제 (PD-1 단백질 억제제)와 비교했다. 분석 결과 CD73 단백질 억제제는 대장암세포 주변의 활성이 저하된 여러 면역세포(조절 T 세포, 피폐된 T 세포, M2 대식세포)를 다시 활성화 시키는 것이 주요 항암 작용 기전이었다. 반면 기존 항체 기반 면역항암제는 면역기능이 떨어진 T-세포를 수를 줄여 항암 효과를 낸다.
한편, 항체 기반 고분자 면역항암제인 PD-1 신호 단백질 억제제는 폐암 등에 상용화된 제제지만, 대장암에 대한 효능은 아직 임상 시험 중이다. 또 고분자 항체 제제의 특성상 인슐린처럼 주사 투약만 가능하다.반면 이번에 실험한 CD73 단백질 억제제는 경구 투약이 가능한 저분자 물질이라 매번 병원을 방문해 주사를 맞는 번거로움을 덜 수 있을 전망이다.
연구팀은 단일 세포 RNA(전사체) 해독 기술로 이 같은 면역항암제의 작용 기전 차이를 이해할 수 있었다. 단일 세포 RNA 해독 기술은 종양 세포뿐만 아니라 면역세포 등 종양 미세 환경과 관련된 여러 세포들의 유전자 발현 패턴을 단일 세포 수준에서 분석할 수 있는 기술이다.
단일 세포 전사체 분석을 주도한 이세민 교수는 “면역 항암제 개발을 위해서는 항암제 작용 기전을 세포 단위에서 이해하는 것이 중요하다”며, “ 대장암 모델에서 CD73 단백질 억제제의 작용 기전을 기존 면역항암제와 단일 세포 수준으로 비교 분석한 연구는 이번이 최초”라고 설명했다.
바이오메디컬공학과 장진호 박사과정 연구원이 제1저자로 참여한 이 연구결과는 종양면역학 분야 국제 학술지 ‘종양면역치료 의학저널((Journal for Immunotherapy of Cancer))’ 온라인판에 7월 12일자로 게재됐다.
연구수행은 한국화학연구원과 한국연구재단의 대학중점연구소지원사업(세포간 신호교신에 의한 암제어연구센터)의 지원으로 이뤄졌다.