국내 연구진이 시판 건강기능식품에서 항암성능을 찾아내고 그 작용원리를 규명했다. 이를 기반으로 이 약품보다 더 성능이 뛰어난 신규 항암물질도 찾아냈다. 안전성이 검증된 약물을 새로운 치료제로 탈바꿈시키는 약물재창출 전략의 성공 사례가 될지 귀추가 주목된다.
UNIST (총장 이용훈)생명과학과 강병헌·이창욱 교수팀은 미토큐(MitoQ)가 암세포 미토콘드리아에서 과다 생성된 트랩원(TRAP1) 단백질을 억제해 항암활성을 가진다는 연구결과를 발표했다. 이 같은 연구결과는 저명 화학 저널인 미국화학학회지(JACS) 표지논문으로 선정돼 12월 1일자(현지시각)로 출판됐다.
연구진은 암세포 미토콘드리아에 침투하는 약물을 연구하던 중 트랩원 단백질에 작용하는 특정 화학구조를 발견하고, 이 화학구조를 갖는 기존 약물들을 스크리닝해 미토큐를 찾아냈다. 미토큐는 미국, 유럽 등지에 시판되는 항산화 건강기능식품이다.
미토큐의 목표물인 트랩원은 암세포 미토콘드리아에서 다량 발견되는 단백질이다. 종양 성장을 촉진하고 항암치료에 대한 저항성을 높이는 암 유발 물질로 알려져 있지만, 이를 억제할 치료 약물 개발은 그동안 연구 초기단계에 머물러 있었다.
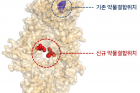
연구팀은 이번 약물 재창출 연구결과로 임상에 실제 사용할 수 있는 트랩원 저해물질을 확보했다. 특히 트랩원의 발암 활성을 강력하게 제어하는 새로운 약물 결합 부위를 세계 최초로 발굴해냈다. 미토큐가 기존에 알려진 트랩원 단백질 활성 억제부위(ATP binding site)가 아닌 다른 부위에 달라붙어 이 단백질의 활성을 억제한다는 사실을 초고해상도 단백질 결합구조 분석 등을 통해 밝혀냈다. 기존 활성 억제부위를 목표로 하는 약물의 경우, 중요 세포 기능을 담당하는 다른 단백질의 활성을 의도치 않게 저해해 예상치 못한 부작용을 유발할 가능성이 있었다.
작용기전도 기존 신약 후보 물질과 다르다. 미토큐는 트랩원 단백질의 입체 구조를 파괴할 뿐만 아니라, 트랩원 단백질이 목표 단백질과 결합하는 것까지 막는다. 미토큐가 목표 단백질이 결합해야 할 자리(client binding site)를 대신 차지하기 때문이다. 암세포의 생존을 돕는 트랩원의 기능이 원천적으로 차단돼 효과가 더 좋다.
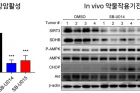
또 연구진들은 확보한 신약개발 원천기술을 바탕으로 미토큐 보다 트랩원 단백질 활성 억제 기능이 뛰어난 신규 항암 물질들을 성공적으로 도출해 논문에 보고했다.
연구를 주도한 강병헌 교수는 “트랩원 억제제의 성능은 암 종류(암종)와 개인별 편차가 매우 클 수 있다”며 “암환자들이 임의로 미토큐를 구입해 복용하는 것은 매우 위험할 수 있어 개발된 치료물질들에 대한 임상연구 결과를 기다릴 필요가 있다”고 부연했다.
신약개발은 많은 비용과 오랜 시간이 필요할 뿐만 아니라, 예기치 못한 독성 발견으로 약물 개발이 중단되는 위험 또한 크다. 안정성이 검증된 기존 약물을 새로운 목적의 치료제로 개발하는 약물재창출 전략에 전 세계 제약회사와 신약개발 연구자들의 이목이 집중되는 이유다. 에볼라 치료제로 개발됐지만 코로나 치료제로 인정받은 렘데시비르나 위궤양 치료였지만 탈모치료에 널리 쓰이는 미녹시딜 등이 대표적이다. 하지만 신약개발 만큼이나 특정 질병에 효과가 있는 치료제를 기존 치료제 중에서 찾아내는 것은 모래사장에서 바늘 찾기 수준으로 어렵다.
한편, 최적화된 물질들을 치료용 약물로 개발하기 위한 후속 연구는 교원창업 기업인 ㈜스마틴바이오와 함께 진행하고 있으며, 환자에게 투여할 수 있는 치료제 개발에 필수적인 비임상 연구가 현재 진행 중이다. 미토큐를 포함한 다양한 항산화제들의 용도특허와 신규 치료물질에 대한 물질 특허도 확보한 상황이다. 특히 논문발표와 함께 국가신약개발사업단(단장:묵현상)의 비임상 후보물질 개발 과제로 예비선정 돼, 환자에게 투여 가능한 치료제 개발 연구가 한층 더 힘을 얻게 됐다.
본 연구는 과학기술정보통신부의 개인기초연구와 중소벤처기업부의 TIPS 프로그램의 지원으로 수행됐다.


![[연구그림] JACS 표지논문](https://news.unist.ac.kr/kor/wp-content/uploads/2021/12/연구그림-JACS-표지논문-770x1024.jpg)