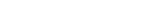기초과학연구원(IBS, 원장 노도영) 유전체 항상성 연구단(단장 명경재, UNIST 바이오메디컬공학과 특훈교수) 이규영 연구위원(현 한림대학교 의과대학 교수) 연구팀은 가장 심각한 DNA 손상으로 알려진 ‘DNA 이중나선절단(Double-strand break)’의 초기 복구 단계가 정교하게 조절되는 메커니즘을 규명했다. 이 복구 과정에 문제가 있으면 유방암, 난소암 등을 일으킬 수 있다.
게놈 DNA는 생명 유지에 필요한 모든 정보를 가지고 있다. DNA 이중나선절단은 게놈 안정성을 위협하는 가장 위험한 DNA 상해 유형이다. 이에 대응하기 위해 우리 몸의 세포는 상동재조합 복구 시스템을 가동한다. 이 복구 시스템은 복구 결함과 돌연변이를 적게 발생시키며, 제대로 작동하지 않으면 세포가 사멸하거나 절단된 DNA가 다른 DNA 부위에 결합하는 등의 변형이 와 암을 유발할 수 있다.
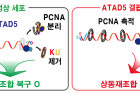
상동재조합 복구는 여러 단계를 거치며, 각 단계는 다양한 복구 단백질에 의해 정교하게 조절된다. DNA 이중나선절단이 발생하면, MRN 단백질 복합체가 절단 인접 부위에 DNA 틈을 만들고, 틈을 기준으로 하여 양 방향으로 DNA 말단절제(End resection)가 일어난다. 말단절제는 절단 부위 말단에 결합해 있는 KU70/80 단백질을 제거해 향후 DNA 복구 합성의 시작점인 말단 부위를 드러나게 한다. 이후 DNA가 절제되면서 단일 가닥으로 노출된 말단 DNA는 정상의 상동 염색체 DNA에 침입해 상동 염색체의 상보적 DNA를 주형으로 하여 새로운 DNA를 합성한다.
연구팀은 이전 연구에서 암 억제 단백질 ATAD5가 상동재조합 복구 과정에서 핵심적인 역할을 수행하다는 사실을 밝혔다. 이번 연구에서는 상동재조합 복구의 초기 단계인 DNA 말단절제 과정에 DNA 복제 단백질 PCNA가 관여하며 ATAD5가 이를 조절한다는 것을 밝혔다. 말단절제는 후속 복구 시스템을 결정하는 동시에 후속 단계에 필요한 DNA 구조를 생성하는 핵심적인 기능을 한다.
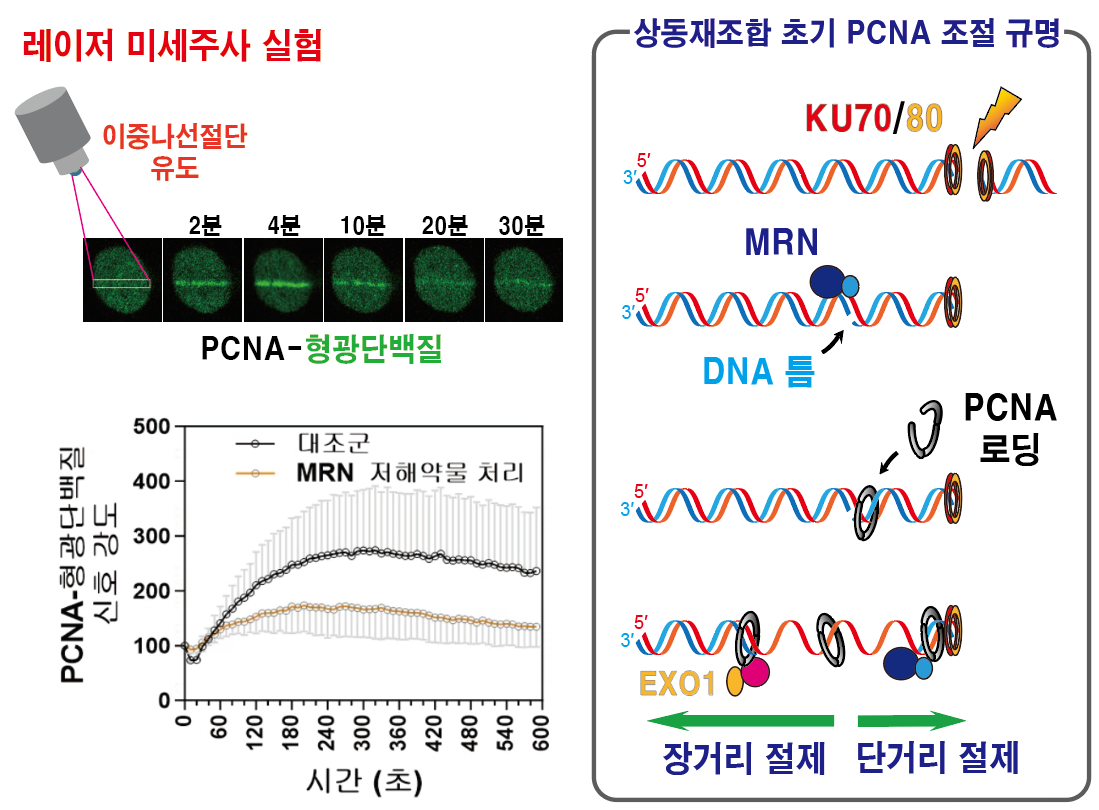
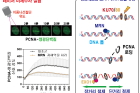
연구팀은 세포에 레이저를 조사해 특정 DNA 부위에 이중나선 절단을 유도한 뒤 형광 표지한 PCNA 단백질의 이동을 실시간으로 관찰했다. 그 결과, PCNA가 수십 초 내에 절단 위치에 나타나고, 일정 시간 이후에 사라지는 것을 확인했다. 연구팀이 MRN 단백질 복합체의 활성을 낮추자 PCNA가 감소하였으며, ATAD5의 양을 줄이면 PCNA가 오래 유지됐다. 이는 이중나선절단이 일어난 직후 MRN 단백질 복합체가 만든 DNA 틈에 PCNA 단백질이 신속하게 결합하고, 일정 시간이 지난 뒤 ATAD5에 의해 DNA에서 분리됨을 의미한다.
나아가 연구팀은 ATAD5가 제대로 역할을 하지 못하는 경우에 복구 결함과 게놈 불안정성이 나타나는 메커니즘도 규명했다. 정제 단백질을 이용한 생화학적․세포생물학적 실험을 통해 분석한 결과, 원활한 상동재조합 복구를 위해 말단절제가 진행 중인 DNA로부터 PCNA 분리가 필수였다. 분리되지 않고 남아 있는 PCNA는 DNA 틈으로부터 절단 부위 방향으로 진행되는 말단절제를 방해했다. 이는 후속 단계인 말단 결합 단백질 KU70/80 제거와 DNA 복구 합성을 저해하고, 전체적인 상동재조합 복구 빈도를 감소시켰다. 이렇게 상동재조합 복구가 어려운 상황에서, 세포는 오류를 유발하는 복구 시스템을 대안으로 선택해 생존을 이어간다. 하지만 이 선택은 결국 돌연변이 증가와 게놈 안정성 저하를 초래했다.
이규영 연구위원은 “상동재조합 복구의 후반 단계인 DNA 복구 합성 과정에서의 PCNA의 역할은 잘 알려져 있었다”라며, “이번 연구로 그간 밝혀지지 않은 복구 초기 단계에서의 PCNA의 역할과 중요성, 분자생물학적 조절 과정을 밝혔다”라고 말했다. 또한, “이번 연구성과는 상동재조합 복구에 문제가 있는 경우 발생할 수 있는 유방암 및 난소암 등에 대한 새로운 항암 전략 수립에 기여할 것으로 기대한다”라고 전했다.
이번 연구성과는 국제 학술지 ‘핵산 연구(Nucleic Acids Research)’에 9월 22일(한국시간) 온라인 게재됐다.
(이 보도자료는 IBS 유전체 항상성 연구단에서 제공하였습니다.)