국내 연구진이 루게릭병을 억제하는 신경보호 유전자를 새롭게 발견했다.
UNIST(총장 이용훈) 생명과학과 임정훈 교수팀은 루게릭 병, 전측두엽 치매와 같은 퇴행성 뇌질환을 억제하는 유전자인 ‘LSM12’와 ‘EPAC1’을 발견하고 이들의 신경세포 보호 경로를 규명했다고 28일 밝혔다. 이 유전자는 루게릭병 환자 신경세포 내 특정 단백질(RAN 단백질)의 비정상적 분포를 교정해 세포 사멸을 억제하는 것으로 나타났다. 이번 연구로 퇴행성 뇌 질환의 조기진단 및 치료제 개발이 새로운 전환점을 맞게 될 전망이다.
세포핵과 이를 둘러싼 세포질 간의 물질 수송은 세포 기능 유지에 꼭 필요하다. 핵-세포질 간 물질 수송 장애는 최근 각종 퇴행성 뇌 질환에서 신경세포 사멸을 유발하는 원인 중 하나로 지목되고 있다.
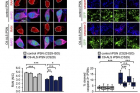
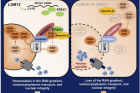
임 교수팀은 신경세포 사멸을 억제하는 ‘LSM12’– ‘EPAC1’ 유전자 경로를 발견했다. 이 유전자 경로로 발현되는 단백질(EPAC1)이 핵-세포질 간 물질 수송 방향을 결정하는 ‘RAN 단백질 농도 차이(농도구배)’를 정상화해 세포 기능을 회복시키는 원리다. 일반적으로 RAN 단백질은 세포핵 내에 더 많지만, 루게릭 병 환자의 경우 세포질로 RAN 단백질 유출되어 비정상적인 농도 차이가 발생한다. ‘LSM12’– ‘EPAC1’ 유전자 경로를 통해 발현된 EPAC1 단백질은 세포질 내 RAN 단백질이 세포핵으로 돌아가는 과정을 도와 RAN 농도구배를 정상 수준으로 회복시킨다.
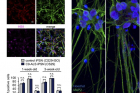
제1저자로 연구에 참여한 이종보 연구원(UNIST 생명과학과 석박사 통합과정)은 “발견된 유전자 경로의 신경세포 보호 작용을 검증하기 위해 루게릭 병 환자의 유도만능줄기세포에서 분화된 신경세포를 이용했다”며 “이 유전자 경로를 활성화해 루게릭병 환자 신경세포에서 관찰되는 RAN 단백질의 비정상적 분포와 세포 독성을 억제했다”고 설명했다
또 연구팀은 ‘LSM12’– ‘EPAC1’ 유전자 경로를 통해 발현된 EPAC1 단백질이 RAN 단백질 분포를 조절하는 세부 원리도 규명했다. EPAC1 단백질은 핵공 복합체(Nuclear pore complex)와 RAN 단백질 간 결합력을 높인다. 이 때문에 세포질로 유실된 RAN 단백질은 핵공 복합체에 쉽게 붙잡히게 되고, 핵 안쪽으로 돌려 보내진다. 핵공 복합체는 핵막(핵을 감싼 막)에 박혀 있는 거대 단백질 덩어리로, 핵-세포질 사이의 물질 교환이 일어나는 통로다.
임정훈 교수는 “세포 내 RAN 단백질의 분포가 핵-세포질 간 물질 수송에 중요하다고는 알려져 있었지만, 그 분자생물학적 조절 기전이 자세히 알려지지는 않았다”라며, “이번 연구로 기존에 그 연관성이 알려지지 않았던 두 유전자가 세포 내 RAN 단백질의 분포를 조절하는 유전자 경로를 구성한다는 사실을 밝혔다”고 설명했다.
임 교수는 이어서 “이번 연구는 루게릭 병, 전측두엽 치매와 같은 관련 질환의 예측과 치료뿐만 아니라 일반적인 노화 과정의 분자생물학적인 이해를 위한 기반 지식 확립에도 큰 기여를 할 것”이라고 기대했다.
이번 연구 결과는 생명과학 분야 학술지 ‘플로스 바이올로지(PLOS Biology)’ 온라인 판에 23일자로 게재되었다. 이번 연구는 서경배과학재단, 한국연구재단의 중견연구 지원사업과 선도연구센터 지원사업, 한국보건산업진흥원의 질환극복기술 개발사업 (질병중심 중개기반연구)을 통해 이루어졌다.


![[연구그림] 유전자경로 활성화를 통한 단백질 분포 정상화 및 신경세포 사멸억제 검증](https://news.unist.ac.kr/kor/wp-content/uploads/2021/01/연구그림-유전자경로-활성화를-통한-단백질-분포-정상화-및-신경세포-사멸억제-검증.jpg)
![[연구그림] LSM12-EPAC1 유전자 경로에 의한 신경세포 보호 모델](https://news.unist.ac.kr/kor/wp-content/uploads/2021/01/연구그림-LSM12-EPAC1-유전자-경로에-의한-신경세포-보호-모델.jpg)