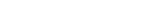인공 단백질 고분자를 세포 안에서 만들어 암세포를 죽이는 기술이 개발됐다. 합성된 단백질 고분자가 암세포의 미토콘드리아 막을 손상시켜, 에너지 공급을 차단하는 원리다. 피부암에 걸린 쥐를 이용한 실험에서도 이 같은 항암 효과를 확인했다. 부작용과 내성이 적은 새로운 항암제 개발에 청신호가 켜졌다.
UNIST 유자형·곽상규 교수팀은 영남대학교 진준오 교수팀과 협력해 암세포의 미토콘드리아 내부에서 스스로 결합하는 단일 분자(단량체)를 개발했다. 단량체 여러 개가 중합 반응으로 결합해 단백질 고분자가 된다. 정상세포에서는 중합 반응이 안 일어나 암세포만 골라죽일 수 있다.
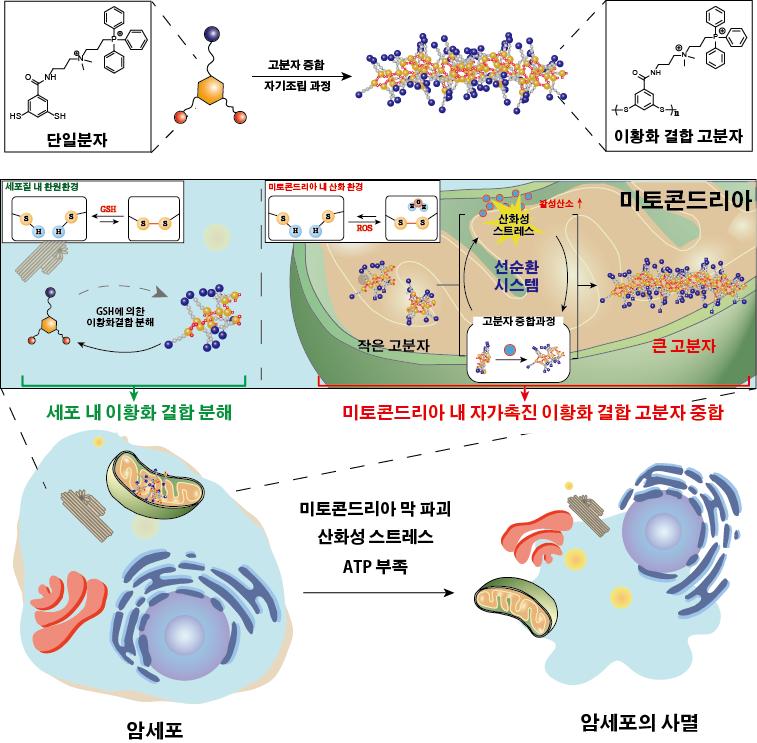
암세포는 세포 내부에 활성산소가 많다는 특성이 있다. 연구진은 바로 이점에 주목해 단량체 분자 구조를 디자인 했다. 단량체 분자들이 이황화결합으로 연결되게 설계한 것이다. 이황화결합은 활성산소가 많은 암세포의 미토콘드리아 내에서는 쉽게 분해되지 않는 결합이다.
합성된 작은 크기의 단백질 고분자는 미토콘드리아 막을 공격해 산화성 스트레스를 주게 되고 이 때 생긴 활성산소가 이황화결합을 더 촉진해 큰 단백질 고분자를 만든다. 선순환 시스템인 셈이다.
이러한 거대 고분자들이 동시다발적으로 미토콘드리아 막을 공격함으로써, 미토콘드리아가 파괴돼 암세포가 죽게 된다. 세포 안에 위치한 미토콘드리아는 세포에 에너지를 공급하는 기관이다.
연구팀은 이를 동물실험으로도 입증했다. 단량체 물질을 쥐의 피부암(SCC7) 조직에 직접 주입한 결과 종양 크기가 3주안에 절반 이하로 작아졌다.
한편, 이 단량체 분자는 미토콘드리아를 표적하는 트리페닐포스포늄 (Triphenylphosphonium) 부분과 고분자 중합을 할 수 있는 다이-싸이올 (Di-thiol) 부분으로 이루어졌다. 다이-싸이올 끼리 만나 이황화결합(Disulfide bond)을 형성하는 중합 반응을 통해 인공 단백질 고분자가 만들어진다.
연구팀은 “이번에 개발한 방법은 세포 내에서 단백질 모방 물질을 생성시켜 세포의 운명을 조절하는 방식으로, 암 치료 뿐만 아니라 다양한 질병 치료제의 개발로 이어질 것으로 기대한다”고 밝혔다.
연구 결과는 국제학술지인 에이씨에스 나노(ACS Nano)에 9월 3일자로 게재되었다. 연구 지원은 한국연구재단과 과학기술정보통신부 및 국가슈퍼컴퓨팅센터 등을 통해 이뤄졌다.