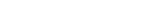국내 연구진이 루게릭병 독성 단백질 생성을 억제하는 신경세포보호 유전자를 새롭게 발견했다. 루게릭병은 독성 단백질이 세포내에서 쌓여 신경세포가 죽는 대표적 퇴행성 뇌질환이다.
UNIST(총장 이용훈) 생명과학과 임정훈 교수팀은 루게릭병, 전측두엽 치매 같은 퇴행성 뇌질환을 억제하는 유전자인 ‘ZNF598’을 발견하고 신경세포 보호의 새로운 분자생물학적 원리를 규명했다고 30일 밝혔다. 이 유전자는 루게릭병 환자 신경세포 내 독성 단백질 번역 산물을 제거해 세포사멸을 억제하는 것으로 나타났다. 이번 연구 결과는 효과적인 퇴행성 뇌질환 조기 진단과 근본적인 뇌질환 치료제 개발의 새로운 열쇠가 될 전망이다.
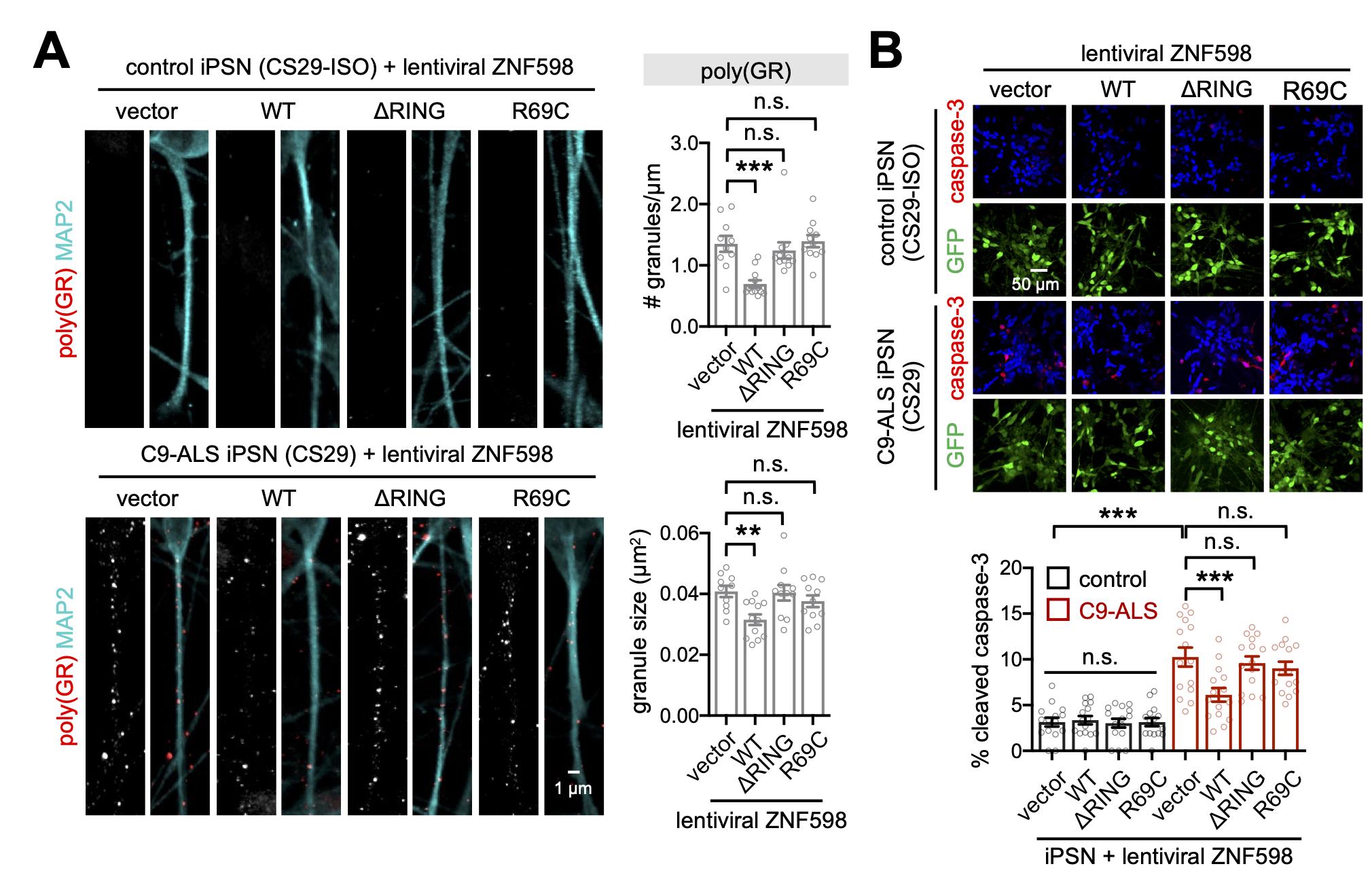
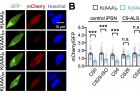
임 교수 연구팀은 ZNF598 유전자를 활성화해 루게릭병 환자 유래 신경세포의 사멸을 억제했다. ZNF598은 단백질 번역 품질 관리 경로를 통해 이러한 기능을 수행했다. 단백질 번역 품질 관리는 비정상적으로 생성되고 있는 번역 중간산물을 인지해 이를 분해하는 과정이다. 단백질 번역을 담당하는 리보솜이 비정상적인 번역 과정 도중에 멈추게 되면(리보솜 정체) 단백질 번역 품질관리 경로가 활성화되고, 번역 산물이 리보솜에서 분리돼 분해된다. 연구결과에 따르면 루게릭병의 독성단백질이 리보솜 정체 현상을 유발한다.
한편, 번역은 mRNA가 가지고 있는 유전 암호로부터 단백질의 기본구조가 합성되는 과정이다. 리보솜이 mRNA의 염기서열에 해당하는 각각의 아미노산을 연결해 단백질 기본 구조인 번역산물을 만든다. 이 과정에서 잘못된 유전 정보가 독성 단백질로 번역되면 신경세포가 죽는 루게릭병과 같은 퇴행성 뇌질환이 발생하는 것으로 알려져 있다.
제1저자로 연구에 참여한 박주민 연구원(UNIST 생명과학과 석박사 통합과정)은 “루게릭병 독성단백질의 세포 독성을 제어하는 유전자를 찾는 과정에서 ZNF598 유전자가 신경세포 퇴화를 억제한다는 단서를 발견하고, 이를 다양한 유전자 편집과 제어 모델을 활용해 검증했다”며 “특히 자체 개발한 기술을 통해 독성 단백질이 번역될 때 리보솜 정체 현상 일어난다는 사실을 밝혀냈다”고 설명했다.
임정훈 교수는 “루게릭병 환자의 유도만능줄기세포에서 분화한 운동신경 세포에서는 ZNF598와 같이 단백질 번역 품질 관리에 관여하는 주요 유전자들이 비정상적으로 발현되며, 결과적으로 단백질 번역 품질 관리가 제대로 일어나지 않는 것을 확인했다”고 설명했다.
임 교수는 이어 “단백질 번역 품질 관리의 기능 분석과 제어 기술이 루게릭병, 전측두엽 치매와 같은 관련 질환의 예측과 진단, 치료 기술 개발에 있어 새로운 돌파구를 마련해줄 것“이라고 기대했다.
이번 연구 결과는 생명과학 분야 학술지 ‘핵산연구(Nucleic acid research)저널’의 9월 22일자 온라인 판에 게재되었다. 이번 연구는 서경배과학재단, 한국연구재단의 중견연구지원사업, 선도연구센터지원사업, 바이오의료기술개발사업을 통해 이루어졌다.